 戒律
戒律血制品行业专题报告:关注疫情带来的血液制品配置价值
与市场不同认识1) 疫情带来的血浆供给缺口可能超过市场预期。 市场认为我国浆站全面停采时间大概只有 2 月,疫情带来的血浆供给缺口只有 10%左右。我们判断,实际血浆供给缺口可能会超过市场预期,并且这些缺口短时间内难以弥补。主要有以下几个原因:1)我国政策规定只有本地居民可以献浆,考虑到外出务工的影响,春节前后应该为献浆高峰期;2)虽然从 3 月下旬开始,大部分浆站已经逐渐恢复采浆,但我们认为在疫情防控没有完全解除的条件下,恐难完全恢复到正常采浆水平;3)我国严格规定了献浆的频率和单次献浆量,后续浆站采浆提升空间有限(尤其是老浆站);4)新设浆站需要审批,加上建设时间,至少需要 12 年,短时间内无法通过新设大量浆站来弥补这个缺口。2) 人血白蛋白全年销售情况可能好于市场预期。 受疫情期间医院手术量大幅度下滑影响,一季度人血白蛋白销售量大幅下滑。但是从全年看,进口人白受全球疫情影响,供给预计有一定缩紧(3 月进口人血白蛋白批签发量已经下滑),国产人白受益。回顾 2019 年类似情况,国产人白预计会量价齐升,对一季度的下滑产生一定的对冲,全年人血白蛋白销售情况可能好于市场预期。3) 疫情对血制品的影响深度可能超过市场预期。 从短期看,此次疫情导致血制品行业供需格局改善。部分品种有量价齐升预期,但是我们认为疫情对血制品行业的影响可能更中长期。(1)过去,因为静丙在临床上存在被当做辅助用药使用的情况,被纳入了部分地方辅助用药目录。经过此次疫情,静丙被纳入辅助用药目录的概率将大幅度下滑。(2)静丙在疫情方面的治疗作用将帮助澄清学术误判,其临床使用将得到改善,静丙终端销售情况有望好转。(3)国家卫健委建议使用康复者血浆治疗重症患者,并多次呼吁新冠肺炎康复患者献浆,民众对献浆的认知度得到提高,有利于提高献浆员渗透率,助力存量浆站采浆量增长。1.受疫情影响,静丙短期需求爆发1.1 新冠肺炎新增静丙需求,加速渠道去库存 国家卫健委连续发布两版《关于印发新冠肺炎康复者恢复期血浆临床治疗 方案(试行)的通知》, 康复者血浆可用于病情进展较快、重症、危重症新冠肺 炎患者临床治疗,规定使用康复者血浆治疗的患者原则上病程不超过 3 周、新 冠病毒核酸检测阳性或临床专家判定患者存在病毒血症,并且建议在病情急性 进展期应当尽早使用。根据临床状况和患者体重决定输注剂量,一般情况下, 输注 4-5ml/kg,通常输注 200-500ml。1 月 27 日,卫健委发布《新型冠状病毒 感染的肺炎诊疗方案 (试行第四版)》中,再次明确对于重型、危重型病例,在 有条件情况下可考虑恢复期血浆治疗。3 月 4 日,国家卫健委发布的《关于印发新型冠状病毒肺炎诊疗方案(试行第 七版)的通知》中,在其他治疗措施中增加了“儿童重型、危重型病例可酌情考虑 使用静脉滴注丙种球蛋白”,静丙治疗正式被纳入国家版诊疗方案。此前,深圳市 第三人民医院的诊疗方案在卫健委版诊疗方案基础上,对于重型、危重型病例,在 免疫治疗措施中,提出根据患者临床症状、胸部影像学进展情况,在病情进展期建 议使用、有条件可用 IgM 型人免疫球蛋白;北京协和医院关于“新型冠状病毒感染 的肺炎”诊疗建议方案(V2.0)中,也提出重症患者依据病情可酌情早期使用 IVIG(静丙) 0.25g/kg/d,疗程 3-5 天。按照北京协和医院诊疗方案测算,假设患者体重 60kg,治疗疗程取中间值 4 天,则单个重症患者静丙注射量为 60g。由于卫健委在疫情后期不再公布累 计重症人数,我们按如下方法进行测算: 重症率:2 月 29 日,国家卫健委官网发布的《中国-世界卫生组织新型冠 状病毒肺炎(COVID-19)联合考察报告》中的重症率为 13.8%;考虑到海 外重症率有可能高于中国,我们按照 15%的重症率进行估算。 累计重症患者估算数量:截止到 2020 年 3 月 31 日,全球累计重症患者估 计为 126450 人,其中中国累计重症患者估计为 12393 人。 新冠肺炎新增静丙需求量测算:按照单个重症患者静丙注射量 60g 测算, 全球新冠肺炎静丙需求量为 7586991g,其中中国静丙需求量为 743553g; 折算成 2.5g 标准瓶,全球和中国新冠肺炎静丙需求量分别为 303.45 万瓶、 29.74 万瓶。2019 年,中国静丙总共批签发量为 1109.94 万瓶,重症患者 静丙需求量约占 2019 年总批签发量的 3%;2019 年一季度静丙总批签发量 为 232.72 万瓶,重症患者静丙需求量约占 2019 年一季度静丙总批签发量 比例为 12.78%。受益新冠肺炎,渠道去库存加速,静丙有望迎来量价齐升。 从全年看,静丙销售量大概率实现高速增长。1.2 静丙 Q1 批签发数量大增,佐证需求旺盛 2019 年全年静丙批签发量为 1109.94 万瓶,与 2018 年基本持平。 2020 年 一季度静丙批签发量为483.61万瓶,同比增长107%;其中1-3月分别为105.08、 205.25、 173.28 万瓶。受疫情影响, 2 月份静丙批签发量较去年同期增加了 181 万瓶,是 2019 年 2 月批签发量的 8 倍(由于上海莱士受上海新兴事件影响, 静丙无法批签发,导致 2019 年 2 月批签发量较低);3 月静丙批签发量较去年 同期增加 78 万瓶,是去年同期的 1.8 倍。整个一季度,静丙批签发量是去年 同期 2 倍,佐证了需求端旺盛。分企业看,泰邦、华兰、天坛、博雅、双林、康宝、卫光、上海莱士批签 发数量都同比大幅度增加,其中上海莱士比去年同期多批签发 71.5 万瓶(上 海基地生产的静丙是由上海所批签发,受上海新兴事件影响,去年同期批签发 量显著低于正常水平);华兰生物比去年同期多批签发 46 万瓶,是去年同期的 2.3 倍;泰邦生物多批签发 26 万瓶,是去年同期 1.6 倍;天坛比去年同期多批 签发 16 万瓶。从生产企业看,2019 年批签发数量排名前 5 的企业分别是天坛生物、泰邦 生物、上海莱士、华兰生物、远大蜀阳,批签发量占比分别为 22.74%、 15.46%、 12.8%、11.89%、8.78%,前五大企业合计占比为 71.67%。2.受疫情影响,原材料血浆供给缩紧2.1 受疫情影响,我国血浆供给端约同比下滑 27% 从 1 月 23 日武汉宣布封城开始,全国全面进入疫情防控状态。受人员流 动性影响,1 月 23 日到 3 月上旬上游单采血浆站血浆采集几乎全面暂停;从血 制品上市公司处了解到,3 月下旬浆站开始逐步恢复采浆,尚未恢复到正常水 平。整体来看,浆站血浆停采约 2 个月;假设 2020 年全国采浆量正常增速为 2017-2019 三年平均增速(8.66%), 正常情况下 2020 年全国采浆量应为 8240 吨;停采 2 月,约少采浆 1648 吨(按平均法计算,实际上由于我国浆站只允许 本地居民献浆,春节前后是献浆高峰期,实际血浆损失应该超过预估值),2020 年采浆量估计为 6592 吨,较 2019 年估计同比下滑 27.56%。此外,虽然目前大 部分浆站已经恢复采浆,但在疫情没有完全消除之前,采浆都无法恢复到正常 水平,最终血浆供给缺口会更高。血浆采集后需要经过 90 天的检疫期,合格后才可投入生产;生产完后,需 要向承担批签发检验或者审核的药品检验机构申请批签发,批签发机构在 5 日 内决定是否受理,受理后需要在 30 天内完成批签发检验,检验合格后,才可销 售。整体来看,从血浆采集到产品上市销售需要 6 个月左右时间。因此,2-3 月 份血浆停采预计会影响 8-9 月份的血制品供应。 2.2 通过新设浆站弥补血浆供给缺口,鞭长莫及 我国血液制品生产原料--血浆唯一合法来源是单采血浆站,而单采血浆站 受到监管部门严格监管。新设浆站需要满足以下要求: 1)申请设置需要通过县、 市、省三级审批,审批时间较长;2)只有生产 6 个品种(必须包含人血白蛋白、免疫球蛋白、凝血因子三大类产品)以上的生产企业才有资格申请新设, 目前能达到条件新设浆站的血液制品生产企业不超过 10 家,导致浆站数量不 能快速增长。由于血浆采集并不能对当地政府产生税收贡献和解决就业,反而 面临较大的监管风险。因此,从 2016 年下半年开始,已经有多个省份明确原则 上不再新设单采血浆站;如果新设基本只考虑批给省内生产企业。综合来看, 生产企业通过新设浆站弥补疫情带来的血浆供给缺口,鞭长莫及。2.3 疫情后加大存量浆站血浆采集,也难以弥补供给缺口 在国际上,血液制品用的原料血浆分为回收血浆和单采血浆两种,回收血 浆主要是医院将全血中的血细胞提取后剩余的血浆;而单采血浆则是通过单采 血浆技术从人体内采浆的血浆。而在中国,原材料血浆监管非常严格,回收血 浆不允许用于血液制品的生产,原料血浆只能通过单采血浆技术采集。献浆员 献浆的频率和单次采浆量都有非常严格的要求,浆站只能通过发展新的献浆员 和提高存量献浆员献浆频率来提高采浆量。我们预计疫情结束后,各大生产企 业会加大宣传力度和提高献浆营养费来刺激采浆,但是受频次、采浆区域等限 制,我们预计加大存量浆站血浆采集难以弥补血浆供给缺口。3.进口人白供给缩紧,国产人白受益3.1 进口人白供给血浆主要来自欧美,采浆量预期下滑 中国主要人血白蛋白进口企业有 CSL、Grifols、Baxalta、Octapharma, 这几家企业的浆站大部分都位于欧美地区。受海外疫情影响,我们判断 3、4 月 份这些进口企业采浆量有所下滑。 CSL:截止到 2019 年底,CSL 共有 237 个单采浆站,分布在美国、德 国、匈牙利和中国(收购武汉中原瑞德) ,2018 年年采浆量为 14000 吨。主要生产基地在美国、德国、瑞士和意大利,产品可销往全球 60 多个国家。 Grifols:总部位于西班牙巴塞罗那,在全球拥有 295 家单采血浆站, 2018 年年采浆量为 9300 吨;主要位于德国和美国,其中美国地区有 252 个浆站、德国有 43 个浆站。 Octapharma:公司共拥有 120 个浆站,分布在欧洲和美国;共有 6 个 生产基地,分布在奥地利、法国、瑞典、德国、墨西哥。 Baxalta:截至 2018 年 11 月,Baxalta 共拥有 122 个浆站,其中美 国地区有 101 个、奥地利有 7 个、捷克和匈牙利有 14 个。3.2 进口人白供给缩紧,国产人白受益 2019 年,进口人血白蛋白批签发总量为 2909 万瓶(折算成 10g/瓶),同 比增长 5%,进口人血白蛋白批签发量占中国人血白蛋白总批签发量 60%,占据了 中国市场大半壁江山,其中 CSL、Grifols、Baxalta、 Octapharma 四家企业 2019 年人血白蛋白批签发量分别为 1322.8、532.37、631.84、388.22 万瓶。受海外疫情影响,海外原材料-血浆供给缩紧,进口人白供给缩紧预期。 2020 年 3 月,进口人血白蛋白批签发量为 301 万瓶,环比减少 55%;国产人血 白蛋白批签发量为 176 万瓶,环比减少 21%。进口人白环比减少幅度远高于国 产,主要是受全球物流影响所致;海外 3-4 月份血浆采集减少,将会影响 4 季 度的产品供应,预期 4 季度进口人白批签发量下滑。回顾 2019 年一季度(受上海新兴事件影响,上海所批签发暂停导致进口 人血白蛋白批签发量减少):2019 年一季度进口人血白蛋白批签发量占比急速 下滑至 44.72%,比重属于 2018 年以来最低值(按季度) 。受益进口人白供给 缩紧,2019 年一季度,国产白蛋白价格和销售量都实现上涨。我们判断,此次 疫情带来的影响严重高于去年的上海新兴事件,预计此次国产人血白蛋白高景 气度持续时间会长于 2019 年。3.3 一季度人白总批签发量大增,进口 3 月批签发量下滑 2019 年中国人血白蛋白总批签发量为 4844 万瓶(折算成 10g/瓶),较 2018 年增长 3.8%,增速略低于上游血浆增速。2019 年人血白蛋白进口数量为 2909 万瓶,占比 60.03%,略高于 2018 年(59.43%),其中 2019Q1 进口占比较低,仅 44.72%,主要是受上海新兴事件影响、上海所批签发暂停导致。按 2019 年批签发量计算,中国市场人血白蛋白主要供给企业有 CSL、 Grifols、Baxalta(含 Baxter)、Octapharma、天坛生物,占比分别为 27.36%、 11.01%、9.04%、8.03%、7.16%。A 股主要上市公司中,天坛生物、华兰生物、上海莱士、泰邦生物、博雅 生物、双林生物、卫光生物2019年人血白蛋白批签发量分别为346.07、230.24、 267.87、350.25、83.18、98.79、112.54,分别较 2018 年同比增长-3.2%、9.8%、26.3%、15.7%、-3.6%、4.3%、20.8%。上海莱士、泰邦生物、卫光生物 增速较大;天坛、华兰、博雅有所下滑。在疫情期间,人血白蛋白被用于补充新冠肺炎患者白蛋白含量,有一定的 辅助治疗功能;但受医院手术量下滑影响,人血白蛋白院内用量整体下滑。 2020 年一季度人血白蛋白总共批签发量为1873万瓶,其中1-3月分别批签发了524、 888、 477 万瓶。与 2019 年同期数据相比,人血白蛋白批签发数量大幅度上涨, 证明人血白蛋白全年需求受疫情影响较小,其中 2 月批签发量是去年同期的 5 倍;3 月批签发数量是去年同期的 1.9 倍。由于国内疫情爆发早于海外地区, 2020 年一季度国产人血白蛋白批签发量 占比下滑到 29.73%。目前,三四月份欧美地区疫情较为严重,三四月份人血白 蛋白进口占比预计下滑;其中 3 月份进口人白批签发量比去年同期减少 30 万 瓶,比今年 2 月减少 50 万瓶。4.其他品种批签发同比有所上升,疫情对全年需求 影响较小我们统计分析了其他血制品品种(除人血白蛋白和静注免疫球蛋白)2020 年一季度批签发数量,结论显示,除乙型肝炎免疫球蛋白有所下滑外,其余品 种一季度批签发数量同比增长或基本持平,侧面佐证这些品种的需求仍然是旺 盛的。狂免、破免、因子类产品均为临床刚需品种,虽然一季度受疫情影响有 所下滑;但从更长的时间维度看,这些品种临床需求旺盛,疫情不改这些品种 的长期需求。随着二季度医院就诊逐步恢复,我们预计二季度所有血制品品种 临床需求都会随着恢复。4.1 一季度狂免批签发量与去年同期基本持平2019 年,我国共批签发了 1144.78 万瓶狂犬病免疫球蛋白,较 2018 年同 比增长 39.8%;其中上海莱士子公司同路生物占比 20%、泰邦生物占比 18%、四 川蜀阳占比 12%、天坛生物旗下武汉血制占比 11%、华兰生物占比 9%。2020 年一季度,共批签发了 244.22 万瓶狂免,较去年同期:增加 23 万瓶, 与去年同期基本持平。狂免临床应用主要是与狂犬病疫苗联合用药,用于狂犬 病暴露风险的人群进,属于刚性需求,并不会因疫情而需求消失。从全年看, 狂免几乎不受疫情影响。4.2 一季度破免批签发量同比大幅增长 2019 年,我国共批签发了 562 万瓶破伤风免疫球蛋白,较 2018 年同比增 长 59.6%,其中天坛生物、泰邦生物、华兰生物批签发量分别占 23%、 23%、 22%; 上海莱士 2019 年破免批签发量仅占比 5%。2020 年一季度,共批签发了 175.65 万瓶破免,较去年同期增加 72 万瓶, 比去年同期增长 69%;与 2019 年四季度批签发量基本持平。分企业看,华兰批 签发了 57.32 万瓶;泰邦批签发了 46.83 万瓶;上海莱士批签发了 23.82 万瓶;天坛批签发了 19.46 万瓶。与狂免一样,破免临床应用也是刚性需求;从全年 看,受疫情影响也相对较小。4.3 一季度乙免批签发量同比有所下滑 2019 年,我国共批签发了 152 万瓶乙型肝炎免疫球蛋白,较 2018 年同比 增长 52%,其中远大蜀阳、天坛生物、泰邦生物、上海莱士、华兰生物批签发 量分别占 34%、31%、18%、10%、7%。2020 年一季度,共批签发了 31.25 万瓶乙免,较去年同期减少 10 万瓶。 分企业看,华兰批签发了 10.81 万瓶;泰邦批签发了 4.25 万瓶;远大蜀阳批 签发了 12.53 万瓶;博雅批签发了 3.67 万瓶。我们判断,受疫情影响,乙免全 年销售量受到的影响程度会高于另外两种免疫球蛋白。4.4 一季度因子类产品批签发量同比有所上升 2019 年,我国分别批签发了 337.29 万瓶凝血 VII 因子、75.84 万瓶纤维 蛋白原、 100.46 万瓶凝血酶原复合物;与 2018 年相比,增速分别为+52%、 -15%、 -15%。因子类产品生产厂家较少,以华兰生物、上海莱士、泰邦生物 3 家龙头 企业为主。2020 年一季度,我国共批签发了 73.02 万瓶 VII 因子,较去年同期增加 27 万瓶;共批签发了 27.54 万瓶纤维蛋白原,与去年同期基本持平;共批签发了 54.3 万瓶凝血酶原复合物,是去年同期的 5.4 倍(仅华兰和泰邦生物有批签 发)。5.短期供需关系改善,业绩增长确定性高一方面,静注免疫球蛋白因为新增新冠肺炎需求,需求端旺盛;另一方面, 受全球疫情影响,国内和海外血浆供给下滑,血制品短期供需格局得到大幅度 改善,行业再次恢复到高景气度。分品种看,静丙和国产人血白蛋白有望实现 量价齐升;其他品种以国内刚需为主,虽然受疫情影响,一季度临床使用量有 所下滑,但随着医院就诊逐渐恢复,使用量将逐步恢复到正常水平。鉴于国内 血制品企业销售收入以人血白蛋白和静丙为主,所以,2020 年血制品企业业绩 增长确定性较为明确。我们统计分析了血液制品上市公司 2020 年一季报或业绩预告/快报,发现 一季度血液制品业务净利润同比上升或持平。博雅生物、卫光生物、博晖创新 等二三线血液制品企业净利润增幅较大,我们判断主要是收入规模(基数)要小一些、静丙收入占比更高,一季度受疫情影响静丙收入增幅要更大。天坛生 物、华兰生物两大血液制品龙头,一季度收入增长幅度要小一些,主要是受人 血白蛋白销量减少所致,其中华兰生物由于其他血制品品种更多,受到疫情的 负面影响要更大一些。按季度看,我们预计一季度业绩增速在 20 年全年是最低的,一方面,受医 院就诊大幅度下滑影响,非疫情直接相关品种销售量下滑;另一方面,去年一 季度受益渠道补库存,基数较高。我们判断,血液制品行业 20 年全年业绩增速 会远高于一季度增速,一方面,临床血制品需求恢复;另一方面,进口人白供 给缩紧将在未来几个季度有所体现,国产人血白蛋白就实现高速增长。6.疫情对血制品行业中长期发展有较大正面影响6.1 疫情帮助静丙澄清学术误判,终端销售情况预计好转 一直以来,静丙在临床上存在被当做免疫增强剂使用的情况,被冠以辅助 用药身份。个别省份将其列入了地方辅助用药目录,更在 2018 年底差点被纳 入国家版辅助用药目录。事实上,静丙在临床上有明确获批的适应症,用于治 疗原发性/继发性免疫球蛋白缺乏症、自身免疫性疾病。此次疫情,静丙临床价 值被进一步夯实,被纳入辅助用药目录的概率会大幅度下滑。此次,静注免疫球蛋白在新冠肺炎治疗中大放光彩,将大幅度提高医护人 员及人民群众对静丙临床价值的认知,帮助企业进行了一场非常有效的学术推 广。经过此次疫情,静丙终端销售情况有望大幅度改善,一方面,经销商出于 对全球疫情的担忧,预计会大幅度提高库存量;另一方面,临床使用率也预计 会有所提高,该品种市场规模有可能会迎来一波快速增长。与海外血液制品发展历程对比,目前我国正处于海外发展的第二阶段,静 丙临床价值在学术上有所误判,需求端难以放量。此次疫情,静丙临床价值得 到进一步夯实,学术误判得到一定程度澄清,将为静丙放量按下快进键。但静 丙能否像海外市场一样,成为最大血制品品种,还得看适应症的拓展。目前, 生产企业对于静丙适应症的拓展动力,我们认为还是不足的。6.2 疫情后,企业销售费用率预计下滑 此次疫情,一方面,帮助血液制品做学术推广;另一方面,行业供需格局 得到大幅度改善。由于疫情带来的供给端缺口无法短期恢复、同时对疫情的长 期担忧,将提高经销商拿货的动力和库存水平。受益供需格局改善,生产企业 销售费用率预计大幅下滑,较大概率恢复到实施两票制以前的水平,对企业盈利水平将产生较大的积极影响。目前,仅华兰生物公布了 2020 年一季报,其销 售费用率为 5.02%,较 2019 年底下降了 9 个百分点。6.3 献浆员渗透率有望提高,助力存量浆站采浆量增长 血液制品行业属于资源型行业,其市场规模严重依赖原材料-血浆;而血浆 规模由浆站数量、献浆员数量、献浆频率、单次献浆量(严格规定,是个定量) 共同决定。浆站设立需要取得卫生监管部门同意,生产企业无权自主设立。由 于血浆采集并不能对当地政府产生税收贡献和解决就业,反而要面临较大的监 管风险,当地政府缺乏设立浆站动力。从 2016 年下半年开始,已经有多个省份 明确原则上不再新设单采血浆站;2017 年全国浆站数量为 231 个,仅比 2016 年增加 6 个浆站。2018 年,全国新增 22 个浆站,新设浆站速度又恢复到了 1516 年水平。据我们了解,主要是云南等空白地区逐渐被挖掘。此次血制品在新型冠状病毒临床上的应用,强调了血液制品在公共安全事 件防控中有着不可替代的作用。经历新冠肺炎后,国家卫健委、以及各地卫生 监管部门有可能稍微放松浆站审批,但是由于血浆的特殊性,应该还是以谨慎 为主。我国大部分群众对血浆采集一无所知,甚至部分群众认为献浆对身体有害, 导致我国献浆员渗透率较低。事实上,一位献浆员在两周内献浆 580ml,对人体 无任何妨碍。按照 2018 年浆站数量计算,我国平均每个浆站采浆量才 34 吨, 渗透率较低。此次,国家卫健委将新冠肺炎康复者血浆纳入诊疗方案;并多次呼吁康复 者献浆,民众对献浆的认知程度得到提高,献浆员渗透率有望进一步提高。按 照全国采浆大省广西的平均年采浆量 50 吨计算(2016 年采浆量为 1302 吨,平 均每个单采血浆站采浆量超过 50 吨), 我国存量浆站采浆量还有 47%的提升空 间;按照采浆量领先的单个浆站采浆量计算(成都蓉生旗下简阳浆站年采浆量 超过 80 吨), 我国存量浆站采浆量还有 135%提升空间。7.投资建议:关注疫情带来的血制品配置价值在新冠肺炎加速静丙库存消化背景下,资本市场对血液制品的关注度再次 提升。实际上,血液制品行业无论短期、中期及长期都具有一定投资价值: 从短期看:受益于疫情,静丙和国产人白有望量价齐升,2020 年,血制品 行业业绩增长确定性高,行业恢复高景气度。 从中期看:我国血浆利用率远低于海外血液制品市场,血制品品种相对欧 美发达地区较为单一;随着更多血制品品种开发上市,行业市场规模有望 得到大幅度提高。 从长期看:参考海外市场,待静丙学术误判澄清、临床适应症大幅拓展, 我国血液制品行业将迎来二次大爆发。7.1 天坛生物:弹性最大的血液制品龙头按照采浆量、浆站数量、血液制品收入规模计算,天坛生物是我国血液制 品绝对龙头。公司旗下拥有成都蓉生、贵州血制(原贵州中泰)、上海血制、武 汉血制、兰州血制 5 家子公司,是我国拥有血制品牌照数量最多的企业,采浆 量增长能力行业领先。虽然公司是行业龙头,但是血浆利用率在行业内并不具 有领先地位;目前公司正在加大血液制品品种开发,单吨血浆利润还有较大提 升空间。整体来看,天坛生物弹性位居几大血制品龙头首位。 业绩情况:公司2019年实现营业收入32.82亿元,同比增长11.97%; 归母净利润 6.11 亿元,同比增长 19.94%。按产品看,白蛋白、静丙、 特免销量分别为413万、331万、237万瓶,同比增长10.80%、15.13%、 26.83%。2020 年一季度实现营业收入 7.58 亿元,同比增长 7.33%; 实现归母净利润 1.31 亿元,同比增长 0.2%;主要是受新冠疫情影响, 静丙销量同比增加。 原材料血浆情况:2019 年公司浆站拓展工作稳步进行,其中兰州血制 获批泾川浆站,公司浆站数量增加至 58 家;成都蓉生宜宾浆站、武汉 血制大同浆站、郧阳浆站郧西分站正式采浆,在采浆站增加至 52 家。 公司采浆量继续稳居行业首位,2019 年达到 1706 吨,同比增长 8.8%, 高于行业采浆量增速(5.8%)。我们判断公司未来采浆量增速仍会继续 高于行业增速,主要有以下几个原因;1)公司目前单个浆站平均采浆 量低于行业平均水平,随着加强浆站管理逐渐见效,存量浆站采浆量 有较大提升空间;2)公司尚有 6 个浆站未投入运营、多个浆站是近两 年新投入运营,后续浆量增长空间较大;3)成都蓉生于 2019 年 11 月 过户广西冠峰 5%股权,顺利托管广西冠峰。广西冠峰是广西省唯一一家血制品企业,而广西采浆量位居我国首位;据《广西壮族自治区 采供血机构设置规划(2015-2020 年)》,广西省未来计划新设 10 个浆 站,按照每个浆站年采浆量 30 吨计算,至少有 300 吨浆量空间。4) 行业未来新设浆站主要倾向于天坛这种集团型血液制品企业,我们判 断云南地区还会新获批一些浆站。 吨浆利润情况:公司虽然总共拥有 14 种血液制品品种文号,但实际 上仅生产人白、人免、静丙、四种特免(含冻干静注人免)共 7 个产 品,导致吨浆利润严重低于同行业其他三家头部企业。我们认为随着 内部五大生产企业协同整合、永安血制投产、因子类产品生产销售, 公司吨浆利润将不断提高: 1)从中生集团新注入的三大血制以及贵州 中泰血浆利用率较低,公司通过内部血浆/组分调拨,提高整体血浆利 用率;2)成都蓉生投资 14.5 亿元兴建的永安血制,截至报告期末, 土建施工已完成约 80%,安装工程施工约完成 70%;受疫情影响,一 季度应该没有实际进展; 2020 年后续施工将进入系统调试,预计永 安项目 20 年四季度-21 年一季度投产。永安血制设计投浆量为 1200 吨,比成都蓉生目前血浆处理能力约提高一倍;随着规模提升,吨浆 利润也有望进一步提升; 3)成都蓉生狂犬病人免疫球蛋白已获得注册 批件;人凝血酶原复合物已经完成临床试验;重组 VIII 因子、纤维蛋 白原、层析静丙处于临床 III 期中。随着这些产品逐渐生产销售,公 司吨浆利润将会大幅度提高。 7.2 华兰生物:相对稳健的血液制品龙头 华兰生物目前主营业务以血液制品和疫苗为主,单抗尚未贡献收入。血液 制品板块,公司共拥有 2 块血制品牌照(河南和重庆各一个)。整体来看,华兰 生物血液制品业务未来发展以稳健为主,一方面,公司继续深挖河南和重庆地 区的浆站资源;另一方面,公司继续加大终端学术推广。 业绩情况:2019 年,华兰生物血液制品板块收入为 26.44 亿元,同比 增长 9.77%;毛利率 57.14%,同比减少 1.7 个百分点。分产品看,人 血白蛋白销售收入为 9.78 亿元,同比减少 4.57 个百分点,约占血液 制品总收入 37%;静丙销售收入为 8.91 亿元,同比增加 47.46%,约 占血液制品总收入 34%;其他品种销售收入为 7.74 亿元,约占血液制 品总收入29%。整体来看, 2019 上半年血制品板块受益于渠道补库存、 进口人血白蛋白供给缩紧,同比增速较高,达 20.76%;下半年血液制 品增速放缓,2019 年整体增速与上游原材料增速持平。2020 年一季 度,华兰生物血液制品收入与去年同期基本持平,主要是疫情期间医 院就诊率大幅度下滑,与疫情不相关的血制品发货都有所下降,抵消 了疫情增量需求。 原材料血浆情况:公司现有浆站 25 个,2019 年采浆量约为 1100 吨, 与上海莱士接近。由于公司只有 2 块血制品牌照,未来新设浆站能力 略次于天坛和上海莱士;公司未来从两方面提高采浆量,预计增速与 行业持平:1)在重庆和河南地区继续开拓新的浆站;2)提高存量浆 站采浆能力。 吨浆利润情况:短期内吨浆利润提升能力有限。公司上市销售血制品 品种位居行业首位,拥有人血白蛋白、免疫球蛋白、因子类三大类产 品,共计 12 个品种。公司目前吨浆利润行业领先,由于短期内无新品 种上市,吨浆利润提升能力有限。7.3 上海莱士:海外优势显著的血液制品龙头 上海莱士是我国血液制品龙头企业之一,主要依靠外延并购扩张不断加大 布局。上海莱士未来新增浆站能力在行业内领先;同时与 Grifols、Biotest 以 及 BPL 之间存在较强的内部协同(技术合作、渠道合作),相较国内其他血液制 品企业,公司在海外布局的优势显著。 业绩情况:2019 年公司主营血液制品业务发展良好,全年实现营业总 收入 25.96 亿元,较上年大幅增长 43.88%;2019 年度归属于上市公 司股东的净利润 6.20 亿元,同比实现扭亏为盈。 原材料血浆情况:公司目前拥有41家浆站,2018年采浆量为1175吨, 采浆水平位居行业第二。旗下拥有上海莱士、同路生物、浙江海康、 郑州邦和四家血液制品生产企业,牌照数量仅次于天坛生物。按照当 前各地新设浆站的趋势,上海莱士未来新增浆站水平在行业内领先。 同时,控股股东持有两家海外血液制品公司 BPL 和 Biotest,这两家 海外企业的采浆量合计约 2700 吨。由于控股股东承诺未来将择机注 入上市公司;考虑 Biotest、BPL 的贡献,上海莱士浆站数量高达 100 家、年采浆量规模可达 3874 吨,跃升为国内血制品企业第一位。 吨浆利润情况:上海莱士目前可生产 12 个血制品品种,吨浆利润领 先行业。相较于华兰生物,上海莱士未来吨浆利润提高的概率要更高。 一方面,上海莱士与海外 BPL、Biotest 两家公司协同效应较大,可通 过技术合作,将两家海外企业的血制品品种生产工艺转移给上海莱士 (已经在长沙新生产基地开展),进一步扩充产品线有望。另一方面, 全球血液制品巨头 Grifols 成为上海莱士第二大股东,二者的协同效 应也较强,预计二者在技术方面也有合作,帮助上海莱士开发新的品 种。 海外优势显著:与国内血液制品其他企业不同,上海莱士已经开始全 球布局,其中控股股东近几年收购了英国 BPL 和德国 Biotest;上市公司收购了 Grifols 旗下核酸检测公司 GDS 部分股权,Grifols 从而 成为上海莱士第二大股东。公司与控股股东海外的两家血制品资产、 Grifols 之间可以共享渠道,一方面,帮助海外人血白蛋白在中国市 场销售;另一方面,借助他们的海外销售渠道,助力上海莱士产品在 海外的销售。此外,Grifols 与 BPL、Biotest 之间也有较强的协同作 用,可以提高公司海外血制品资产运营管理及盈利能力(Grifols 已 经收购 Biotest 在美国的浆站资产)。……(报告观点属于原作者,仅供参考。报告来源:国融证券)如需报告原文档请登录【未来智库】。
 逆之则凶
逆之则凶罗氏Hemlibra在体内存在因子VIII抑制剂的患者中安全有效!
罗氏(Roche)近日在2020年国际血栓与止血学会(ISTH)虚拟大会上公布了III期STASEY研究的第二次中期分析结果,该结果加强了Hemliba(Emizumab)在III期HAVEN临床项目中的安全性。在STASEY研究中,Hemlibra在体内存在因子VIII抑制剂的A型血友病成人和青少年患者中具有疗效、没有发现新的安全信号,这与之前的安全性观察结果一致。进一步的新分析数据表明,接受Hemliba治疗的患者,能够在不使用额外的预防性(prophylactic)凝血因子的情况下进行某些小手术。罗氏首席医学官兼全球产品开发主管Levi Garraway医学博士表示:“这些重要的安全数据继续增加了大量的临床证据,强化了Hemliba重新定义A型血友病患者护理标准的潜力。STASEY研究反映了我们继续专注于提供有价值的见解,以满足血友病社区的需求,并加强我们在临床实践中对Hemliba的了解。”STASEY是一项单臂、多中心、开放标签IIIb期临床研究,患者接受Hemliba治疗平均50.9周。所有出血(包括治疗的出血、治疗的自发性出血、治疗的关节出血和治疗的靶关节出血)的年化出血率(ABR)均较低,167例患者(85.6%)的治疗出血为零。在STASEY研究中,报告了2例与Hemlibra无关的血栓事件(TE):一例是ST段抬高性心肌梗死,治疗医生评估为与Hemlibra无关,第二例是拔牙部位的肥大血块,这是手术的一个已知并发症。STASEY研究的第二个中期分析包括了193例体内存在因子VIII抑制剂的A型血友病患者的数据,这些患者每周接受一次Hemliba预防性治疗。没有报告与Hemliba相关的血栓性微血管病或严重血栓事件(TE),并且没有观察到新的安全信号。33例(17.1%)患者报告了与Hemliba相关的不良事件(AE)。在STASEY研究中,发生在≥10%患者中的最常见不良反应是常见的感冒症状鼻咽炎(12.4%)、头痛(11.9%)和注射部位反应(ISR,11.4%)。报告的ISR严重程度为轻或中度,没有患者因ISR而中断治疗。年化出血率(ABR)也与之前报告的III期HAVEN研究的观察结果一致。另一项单独的分析,描述了接受Hemlibra治疗的患者开展小手术和非计划大手术的程序和结果,尽管在STASEY研究中这不是正式的手术终点。结果表明,体内存在因子VIII抑制剂的A型血友病患者,在接受Hemlibra治疗的同时进行某些小手术,可能不需要额外的预防性凝血因子。大多数小手术(n=20/31)都没有使用预防性凝血因子(64.5%),其中的85%(n=17/20)没有发生术后出血治疗。在计划外的大手术中(n=9),8例用预防性凝血因子解决,其中4例用重组因子VIIa成功地解决了出血。这些发现与先前在关键性HAVEN研究中观察到的手术分析结果一致。Hemlibra是一种双特异性单克隆抗体,能将激活天然凝血级联反应和恢复天然凝血过程所必需的2种蛋白质——凝血因子IXa和X聚集在一起,恢复A型血友病患者的凝血过程。在临床研究中,Hemlibra已被证明能够显著减少出血事件并改善机体功能。对于那些存在因子VIII抑制剂(抗FVIII抗体)的患者,Hemlibra仍能很好的起作用。Hemlibra由中外制药研制,目前由中外制药、罗氏及旗下基因泰克合作开发。该药的开发,旨在帮助克服A型血友病群体当前面临的临床挑战:现有药物药效持续时间短、VIII抑制剂的产生、频繁的静脉输注需求。Hemlibra于2018年10月首次批准上市。截至目前,该药获90多个国家用于体内存在因子VIII抑制剂的A型血友病患者(基于HAVEN 1和HAVEN 2研究)、获全球70多个国家批准用于体内不存在因子VIII抑制剂的A型血友病患者(基于HAVEN 3和HAVEN 4研究),预防或降低出血事件的发生频率。该药的开发,旨在帮助克服A型血友病群体当前面临的临床挑战:现有药物药效持续时间短、VIII抑制剂的产生、频繁的静脉输注需求。值得一提的是,Hemlibra是近20年来获批治疗体内不存在凝血因子VIII抑制剂的重度A型血友病患者的首个新一类药物,该药同时也是唯一一个可用于体内存在或不存在因子VIII抑制剂A型血友病患者进行自我皮下注射并具有多种给药方案(每周一次、每2周一次、每4周一次皮下注射)的预防性治疗药物。根据罗氏发布的业绩报告,Hemlibra在2019年销售额达到了13.8亿瑞士法郎。而随着适用人群的扩展和市场的扩大,Hemlibra的商业销售预计将大幅增加。在2018年,科睿唯安曾预测,Hemlibra在2022年的销售额将达到40亿美元。原文出处:New data from phase IIIb study reinforces safety profile of Roche’s Hemlibra in people with haemophilia A来源:生物谷
 故外天地
故外天地4月17日是世界血友病日| 血友病分甲乙两型,经济负担差距大
健康时报记者 周学津“11年前,我在自己两岁的孩子身上发现了4-5处瘀青后,一天之内带着孩子跑了三家医院。当时,我想着区里的医院都是小医院,万一是误诊呢,可去了大一些的医院,医生都确诊是血友病。”说起11年前带孩子看病的往事,小泽(化名)的爸爸有些动情,“7月的天,酷暑难耐,而我的心如坠冰窟。为什么偏偏是我的儿子,他还这么小,连血友病三个字都不会念,就被要求带着这个名字度过一生。”“血友病是一种先天性血液凝固异常的出血疾病,作为一种X染色体隐性遗传疾病,临床中多为男性发病,女性为携带者,发病较为罕见。”4月17日是世界血友病日,中国医学科学院血液病医院(血液学研究所)血栓与止血诊疗中心主任杨仁池教授在接受健康时报记者采访时介绍,重型血友病患者出血首发年龄小,出血程度重,常出现肢体功能障碍。而轻型患者可无自发性出血表现,多在外伤或手术后出血异常增多而被诊断。在临床中,血友病分为甲型血友病(或称血友病A)和乙型血友病(血友病B)两种类型,主要是由凝血因子VIII(FVIII)和凝血因子IX(FIX)基因突变所致。”杨仁池教授介绍,我国需要定期接受凝血因子替代治疗的血友病患者估计约4万左右,其中甲型血友病占约80%-85%,乙型约15%-20%。”血友病患者只要补充凝血因子及时,日常生活照顾得好,在外表上和正常人没有区别。据了解,在国内,血友病的治疗药物选择主要以血液制品、重组人凝血因子药物为主,国内已经上市了7种治疗药物,其中6种已经纳入国家医保目录。与此同时,大部分城市将血友病纳入门诊特殊/慢性/大病病种,门诊与住院报销待遇一致,在国家、地方政府的大力支持下,血友病患者的治疗和生存状况整体获得了较大的提升和发展。其中,杨仁池教授重点提到了乙型血友病治疗。乙型血友病治疗的关键在于持续性的标准化治疗,乙型血友病患者如果能够足量足疗程使用重组人凝血因子IX等治疗药物,患者及家属在身体、心理健康方面都将获得全面、较大程度的改善。杨仁池教授提示,血友病患者需长期输注,在门诊无法报销的情况下,一旦干预不及时,出血频发,关节逐渐受损,会有生命危险,对医疗资源的使用反而是较大的负担。“患者治疗中的‘最后一公里’的问题,成为制约乙型血友病患者获得良好疾病控制、更高质量生活的桎梏。”谈起乙型血友病治疗,全国罕见病诊疗协作网办公室副主任、国家卫健委罕见病诊疗与保障专家委员会副主任委员兼办公室主任李林康介绍,相较于甲型,大多数乙型患者未得到及时、全面的诊治,受医保报销额度的限制,目前进行预防治疗的患者十分有限。成人患者中,仅有53%的成人患者进行按需治疗。儿童用量较小,不易达到报销额度,19%未采取预防治疗。“再难我也要救我的孩子,需要药我就买,需要钱我努力赚,我只希望我的孩子能健康成长。”讲到小泽的治疗之路,小泽的爸爸露出微笑,“日子一天比一天好,我曾在小泽六年级时问过他,为什么想上学,他说想成为社会有用的人。”去年11月份,中国罕见病联盟联合中国血友病协作组发布了《中国乙型血友病患者生存状况及医疗保障需求调研报告》,旨在全面了解中国乙型血友病患者在用药、医疗保障、社会适应等环节的生存现状,呼吁社会各界更多地关注乙型血友病患者,为乙型血友病医疗保障政策的完善提供扎实的论证,同时呼吁更多的社会关注和多方保障资源的投入,从而改善中国乙型血友病患者的生活质量。李林康理事长、杨仁池教授都希望国家、各地政府能够充分认识到乙型血友病患者在治疗中面临的种种困难,帮助简化患者诊疗流程,试点并推行有利于患者的长处方,敦促更多城市将乙型血友病纳入门诊报销、提升报销比例、减少患者自付部分,减轻现金流的压力,以助于患者能够坚持长期治疗;同时,将预防治疗的政策也进行优化,减少这部分患者由于治疗不充分导致的出血和更严重的身体健康情况。
 边区造
边区造创新药行业深度报告:双抗,下一代抗体药物
(报告出品方/作者:平安证券,叶寅、黄施齐)一、 大多双抗药物仍处于早期临床,近年有望迎来收获期1.1 历经 60 年发展,双抗技术已逐步成熟天然抗体是由两条重链(H 链)和两条轻链(L 链)的氨基酸组成的四聚体,含两个相同的结合抗 原位点的 Fab结构域以及一个 Fc 结构域,靶向单一抗原表位。而双特异性抗体(BsAb)则是通过 化学偶联、重组 DNA 或细胞融合的方式,将 2个不同的 H链和 2个不同的 L链组合,从而可以同 时特异性结合两个不同抗原表位的人工抗体。自概念首次被提出,双抗技术至今已发展了 60年。随 着基因工程和抗体工程等分子生物学技术不断突破,双抗的研发和生产日益成熟。1.2 双抗药物已出现超 20 亿美元收入的重磅品种目前已获批上市的三款产品分别为 Removab、Blincyto 和 Hemlibra。其中,Removab 作为全球首 个商业化的双抗药物,因销售不佳及副作用等原因于 2017 年退市。而 Blincyto和 Hemlibra两款双抗药物技术相对更成熟,在临床上也展现了较好的疗效,因此自上市 后一直保持放量,2020 年分别实现 3.79 亿美元和 21.90 亿瑞郎(约24.44 亿美元)收入。从放量速度来看,Blincyto 的放量速度相对较慢,上市后的年复合增速约为 138%,可能是由于 Blincyto 半衰期仅 2 小时,患者需要频繁给药,因此虽然疗效显著但与其他现有疗法相比依从性更 差所致。而 Hemlibra 上市后的年复合增速超过 300%,并于上市第三年成功突破 20 亿美元销售额 大关,成为重磅品种,主要是由于 Hemlibra相比血友病传统疗法在给药便利性和疗效上均有所提升 所致:与现有血友病每周注射三次的治疗方式相比,Hemlibra仅需每周甚至每两周注射一次,显著 提高患者依从性;同时,Hemlibra疗效提升较为显著,还可以避免耐药性出现,因此部分取代了传 统疗法,实现快速放量。伴随双抗研发技术的不断进步,在研的双抗药物也进一步改善了用药周期 和副作用的问题,未来有望产生更多重磅品种。1.3 肿瘤领域热度最高,未来 3-5 年有望迎来上市爆发期由于双抗相比单抗在成本、副作用和疗效等方面具备一定优势,因此被视为第二代抗体疗法,近年 发展迅速,成为了癌症、炎症、病毒感染及自身免疫病等许多疾病治疗的开发热点。此外,双抗还 具有能够靶向过去“不可成药”靶点的潜力。近日,约翰霍普金斯大学的研究团队在《Science》杂 志上发布最新研究,成功开发出靶向 RAS 和 p53突变体的双抗,这两个靶点在传统小分子药物领域 很难被有效靶向,而双抗取得了突破性进展,其治疗潜力得到进一步验证。根据药渡数据库显示(不完全统计),全球目前有 218款双抗药物处于临床及临床前阶段。从适应症 来看,超过 80%的管线集中在肿瘤领域,其中实体瘤赛道较为热门。从研发阶段来看,在研管线中,有 157 个已经进入临床阶段,其中大多数处于临床 I 期阶段。伴随 研发逐步推进,未来 3-5 年将有望迎来双抗药物上市井喷。从国内外进展情况来看,我国的双抗研 发相比国外起步较晚,因此目前我国大部分管线主要集中在临床前阶段。现在进入临床 III 期的双抗药物一共有 8款,其中 1款由国内企业自主开发,是康宁杰瑞的 KN-046。 而进入 III 期双抗药物数量最多的公司是 Roche,共有 3 款药物。1.4 双抗近年成为管线合作的热门投资方向从目前企业的布局情况来看,国外企业由于起步较早,因此双抗研发管线较为丰富。拥有最多双抗 研发管线的企业是 Roche,Amgen 和 Janssen 紧随其后。国内企业方面,拥有较多双抗药物布局 的企业主要有康宁杰瑞、康方生物、信达生物和友芝友等。除了自主研发外,为快速抢占赛道,国内外各大企业也通过合作研发以及授权引入等方式对双抗管 线进行布局。二、 双抗作为第二代抗体药物有望填补治疗空白由于双抗是人工构建的功能性抗体,虽然相比单抗有更多优势,但其设计和生产相比天然抗体存在 更多难点。双抗主要通过将 2个不同的 H链和 2个不同的 L链组合而成,这种随机组合方式可以产 生 16种不同的组合,而其中仅有 12.5%的产品具有所需的双重特异性,很难从中分离出目标组,这 一问题被称为“链错配问题”。双抗的研发主要是围绕如何在有效组合 2个不同抗原识别位点的同时 提高目标抗体均一性和产量开展合理的结构设计。2.1 双抗结构分为全长型和片段型,技术平台各有千秋根据结构特征,双特异性抗体可以大致被分为 2类,分别为不含 Fc 片段的双特异性抗体(非 IgG样双抗,片段型双抗) 和含有 Fc 片段的双特异性抗体(IgG 样双抗,全长型双抗)。IgG 样双抗和非 IgG 样双抗的主要是区别为是否有与天然的 IgG 相似的结构和分子量,其中, 是否含有 Fc 区域是导致这两个类型双抗产生生物活性差异的主要原因之一:IgG 样双抗(有 Fc 部分):具有 Fc 介导的效应功能,如抗体依赖性细胞介导的细胞毒性作用 (ADCC) 、补体依赖性细胞毒性作用(CDC) 和抗体依赖细胞介导的细胞吞噬作用(ADCP),可 以进一步加强双抗的肿瘤杀伤能力,具有较高免疫原性。IgG 样双抗由于具有较大分子量以及 能够通过结合 Fcγn参与循环利用,因此具有较长的血清半衰期。此外,IgG样抗体的工艺较 为成熟,并且 Fc 部分有助于提高抗体纯化的溶解度和稳定性,生产相对便利。非 IgG样双抗(缺乏 Fc 部分):仅通过抗原结合力发挥治疗作用,免疫原性较低,安全性相对 较高。由于其相对分子质量较小可渗透到肿瘤组织,因此具有更强的治疗效果。然而,非 IgG 样双抗的血清半衰期非常短,已上市的 Blincyto半衰期仅为 2小时,而单抗药物的半衰期通常 超过 100 小时。此外,非 IgG 样双抗CMC 工艺较为复杂。2.1.1 IgG 样(全长型)双抗技术开发旨在解决错配问题IgG 样双抗分子设计时利用整个 IgG 结构作为骨架,构建一个具有双特异性或者多特异性的二价或 多价抗体,由于具有跟天然抗体一样的结构,CMC工艺更成熟,且体内分布行为更好预测。从结构 来看,IgG-like 双抗又可以进一步被分为对称模式和不对称模式。对称 IgG 样双抗具备和天然 IgG 相似的结构和较高的稳定性,不存在错配问题,因此 CMC 相对简单且易于生产;而不对称 IgG 样 双抗具有桥接功能,并且可以通过调节两个抗体的效价进一步调节双抗对两个靶点的亲和力,有望 提高双抗的安全性和特异性,但其生产相对复杂,需要解决重链和轻重链的错配问题。由于 IgG-like 双抗面临的主要问题是生产中的错配问题,各技术平台的设计也主要是围绕如何解决不同重链之间的错配、重链和轻链之间错配开展,逐步形成各自的特色:针对重链之间错配问题杵臼结构(knobs-into-holes,KIH)是最早被提出来用于解决重链错配问题的技术,由Genentech 公司开发。具体方法是利用基因技术将重链 CH3区的体积较小的氨基酸突变为较大氨基酸,形 成突出的“Knobs”型结构; 同时将另一个抗体重链 CH3区较大的氨基酸突变为较小的氨基酸, 形成凹陷的“holes”型结构,从而使两个重链结构可以咬合形成异源二聚体,减少约 90%的 重链错配。目前 KIH 专利保护期已过,多家企业在其基础上进行改良衍生出新的技术平台。针对重链和轻链之间错配问题虽然 KIH解决了重链错配问题,在生产中仍然面临轻链错配问题,即两种不同的轻链会与重链 的异源二聚体错配,目标双抗的占比仅从 12.5%提升至 25%。为进一步解决这个问题,Roche 在 KIH 的基础上发展了 CrossMab技术:首先在 Fc 部分设计了 KIH 异源二聚体连结,同时将 其中一个抗体轻重链 Fab部分进行完整或部分交换。从而实现轻链的正确联合,避免在同一宿 主细胞共表达的过程中两种抗体因发生轻链错配而出现一些无功能的 BsAb,产出率提升至 90%。该技术的代表产品为Roche研发的 RG7221和 RG7716,两者均为抗Ang2/VEGF双抗。从天然抗体形成中得到启发Fab臂交换是人体内的 IgG4抗体也会天然发生的一个过程,然而该过程是随机的,可以在两个相同 抗体之间发生。Genmab 对交换机制深入研究后发现,在抗体的 CH3 区引入不对称突变,可迫使 Fab 臂互换反应变为定向的,从而得到高度稳定的异二聚体蛋白,并基于此开发了可以产生稳定双 抗的 DuoBody 技术平台。该技术已实现 1500L 规模的产业化应用,受到广泛关注。Genmab 已与 多个制药公司,包括艾伯维、强生和吉利德等达成合作,利用 DuoBody 共同开发双抗药物。随着双抗研发热度持续提升,目前全球范围内已出现了超过 30个 IgG-like双抗技术平台,部分产品 已进入临床试验。2.1.2 non-IgG-like 双抗技术开发旨在解决半衰期问题非 IgG 样双抗主要是以可变域或 scFvs 为构建骨架,一般没有 Fc 区域,分子量相对 IgG 样双抗更 小,而这也是导致非 IgG 样双抗半衰期短的主要原因:完整的 IgG 抗体分子量约为 150kDa,通过 肝脏被清除;没有 Fc 片段的抗体分子量小于 60kDa,通过肾脏被清除,肾脏清除的速度快于肝脏。 此外,由于没有 Fc 结构,片段型双抗无法参与受体 Fcγn结合介导的循环利用,导致半衰期较短。 因此,各技术平台持续改良提升双抗的半衰期,主要通过融合 Fc 区域以及增加分子量。融合 Fc 结构区Amgen公司开发的 BiTE 是非 IgG样双抗中最早拥有上市品种的技术平台,主要是将一个抗体 的scFv与另一个抗体的scFv通过合理的linker串联成双抗。基于该平台开发的 Blincyto于2014 年获 FDA 批准上市,其使患者的中位总生存期相比标准化疗延长了一倍,效果显著。然而, Blincyto 的半衰期仅有 2 个小时,患者需要频繁给药,依从性较差,因此上市后的销售表现也 受到影响,2020年仅实现 3.79亿美元收入。为改善半衰期问题,Amgen在 BiTE 平台基础上 发明了 Half-Life Extended(HLE)-BiTE 技术,通过将 Fc 结构融合入 BiTE 结构,大幅改良其 半衰期,从 2小时延长至 44-167 小时。增加分子量,形成多聚体增加分子量使其通过肝脏清除也可以延长半衰期,主要通过串联多个抗体识别区域的方式,构 建“1 + 2”或者“2 + 2”结构。这种方式在增加相对分子质量的同时,还可增强抗体的效应机 制,例如 TandAb。TandAb是由 Affimed 公司利用 ROCK 平台开发的一类四价双抗,该类双抗 包含 4个 Scfv结构,可以同时结合两种抗原并且每种抗原有两个结合位点,具有更高效力,在 研药物包括 AFM24、AFM11、AFM13等。TandAb分子量介于全分子抗体和 BiTE 之间,约为 106kDa,具有比 IgG更短但比 BiTE 更长的半衰期。Affimed 与 Genentech达成了 50亿美元 合作,将利用该平台共同开发更多新型免疫疗法。融合人血白蛋白结构区,与其他分子偶联Nanobody 首先由 Ablynx 公司开发而成,是一种单域抗体,来自于骆驼及羊驼体内的一种缺失 轻链的重链抗体的可变区片段。Nanobody 可以通过接头连接从而实现多特异性结合,其优点 主要是分子小、稳定性高、易于连接,小尺寸使其易于穿过较深的组织并靶向一些正常 IgG抗 体难以靶向的表位。但缺点是半衰期较短。为解决半衰期问题,Ablynx 将 Nanobody 与人血清 白蛋白或白蛋白结合蛋白融合,半衰期可由几个小时延长至 2-3 周。目前 Ablynx 已经与诺华、 诺和诺德、默克、艾伯维、勃林格殷格翰等多家药企达成了合作。目前全球范围内已出现了超过 10 个 non-IgG-like 双抗技术平台,部分产品也已进入临床试验。2.1.3 双抗具体结构的设计还要取决于其靶点作用机制整体来看,双抗的结构形式决定分子的生物学活性。不同靶点双抗或者相同靶点双抗之间的差异性 以及其效果和安全性,主要会被五个结构因素影响,分别为抗体亲和力和效价、Fc 区、几何结构、 连接子和分子量。而这五个结构的选择通常取决于双抗作用机制以及适应症的类型,根据使用靶点 机制的不同,双抗的设计和结构也会有不同考量。2.2 双抗作用机制主要分为四类,有望填补现有疗法的治疗空白按照双抗不同的作用机制来看,双抗的靶点机制主要分为 4 类,分别为细胞桥接、双靶点阻断、免 疫细胞激活、促蛋白复合体生成。双抗的出现有望填补部分目前小分子药物和单抗难以解决的适应症空白。2.2.1 细胞桥接机制展现出相较 CAR-T更好的疗效双抗的一个重要作用机制是介导免疫细胞杀伤肿瘤。机体免疫系统本身就具备免疫监视功能,可以 识别和清除癌变细胞。然而,肿瘤细胞可以通过下调 MHC 分子表达等方式逃逸免疫监视,从而在 体内迅速增殖,形成病灶。双抗具有两条抗原结合臂,可以设计成其中一条与肿瘤靶抗原结合,另 一条与效应细胞上的抗原结合,从而使效应细胞激活,并重新识别、清除肿瘤细胞,与 CAR-T作用 机制有点相似。T细胞和 NK 细胞是较常用效应细胞类型,其中热门的表面靶点是 CD3 和 CD16。 但该机制主要是激活肿瘤浸润 T细胞,因此对“热肿瘤”以及血液肿瘤的效果相对较好。除 CD3外,部分公司选择 PD-1、4-1BB 等免疫靶点,相比之下,CD3 对 T细胞的激活和招募能力 更强,但对双抗平台的研发设计能力要求也较高。已上市的三款药物中,Removab(CD3 x EpCAM) 和 Blincyto(CD3 x CD19)都是使用靶向 CD3的桥接机制。其中 Removab 虽然展现出较好的疗效, 但会产生较严重的副作用,其主要原因是该药即使低剂量给药也会引起 T细胞过度活化,从而诱发 细胞因子快速且剧烈的释放,引发较严重的细胞因子风暴。研究发现,T 细胞的过度活化主要和该 抗体的 CD3 抗体 Fc 介导的免疫效应以及亲和力等因素相关。 因此,为避免出现 Removab 类似的毒副作用,细胞桥接双特异性抗体的设计重点在于选择合理的 CD3 抗体亲和力范围,具有特异性的肿瘤靶点、同时尽可能抑制 Fc 介导的效应功能。Blincyto采用 的是 BiTE 技术,与 Removab 相比去除了 Fc 结构,因此不会引发其他效应细胞活化并进一步激活 细胞因子,降低了 T细胞过度活化风险。此外,Blincyto的 2个抗体均采用 ScFv结构,相比 Removab 的完整 IgG结构,一定程度上降低了 CD3亲和力。同时,CD19靶点的特异性较高,而 EpCAM 也 普遍表达于正常细胞,因此 Blincyto 的肿瘤特异性更强,安全性相对较好。为进一步提升安全性,Roche开发了 2:1 TCB 结构的双抗 Glofitamab,通过设计成 2价结合 CD20,单价结合 CD3的结构, 增强双抗的特异性靶向能力,并降低 CD3 亲和力。从临床数据来看,双抗已体现出与单抗相比差不多甚至更好的疗效,CR(完全缓解率)普遍较高。 与目前较为热门的 CAR-T疗法相比,双抗也展现出亮眼的治疗效果,甚至在 CAR-T 治疗失败患者 中也体现出完全缓解的疗效,同时还具备给药方便以及费用低的优势。2.2.2 双靶点信号通路机制有望阻断解决耐药问题同时阻断双信号通路也是双特异性抗体重要靶向机制,常用于肿瘤治疗和自免疫治疗领域。受体酪 氨酸激酶(RTKs)是最大的一类酶联受体,在细胞增殖过程中发挥重要调节作用,其在肿瘤细胞表 面的异常表达会导致肿瘤细胞恶性增生,因此 RTK 抑制剂是肿瘤药的热点开发方向,目前已在治疗 中得到广泛应用。但是,肿瘤细胞可以通过补偿信号通路或同靶点不同表位之间的同源或异源二聚 体激活细胞内信号进行逃逸或产生耐药性。因此双抗通过同时靶向两个或多个 RTKs 或其配体,可 以减少肿瘤细胞逃逸,克服耐药性,提高治疗效果。在自免疫疾病治疗中该作用机制也较为常见。在肿瘤治疗中,由于部分抗原不止表达于肿瘤细胞,因此该机制可能会杀伤表达相应抗原的正常细 胞,造成与治疗相关的不良反应,存在脱靶毒性。为减少副作用,需要寻找具备较强特异性的肿瘤 靶点,例如 CD19、CD20、HER2等。此外,为提高效果,这类双抗需要寻找选择具有协同作用的 两个靶点,其设计重点和难点在于调节两个靶点之间的亲和力以及空间距离,使双抗结构能够同时 阻断两个信号通路,达到杀伤效果。该机制下,根据不同靶点选择主要可以被分为三类:补偿通路 阻断、不同表位阻断以及靶向肿瘤生长环境。补偿通路阻断此前强生在 EMSO大会上公布的数据亮眼的 Amivantamab(c-Met x EGFR)属于这个作用机 制。该款双抗被设计为 1+1不对称结构,可以同时阻断 MET和 EGFR两条信号通路,用于治 疗非小细胞肺癌。EGFR 突变的 NSCLC 患者会先使用 EGFR 激酶抑制剂(TKI)治疗,然而 在用药后多数会出现耐药性,目前还没有治疗三代 EGFR抑制剂耐药的药物上市。此外,EGFR 第 20 号外显子插入突变是肺腺癌的一个独特亚群,占所有 EGFR 突变的 9%,该类患者对目 前的 TKI治疗不敏感,无标准治疗。Amivantamab在临床试验中体现出对于奥西替尼耐药患者 和第 20 号外显子插入突变患者的疗效,填补目前仍然空白的适应症,有望成为三代 EGFR 抑 制剂耐药后的治疗选择。从临床结果来看,Amivantamab 联合拉泽替尼的治疗组合能够对奥西替尼耐药的患者产生疗效, 总体反应率(ORR)达到了 36%,临床收益率(DCR)达到 60%,有望为部分耐药以及目前 治疗手段空白的适应症带来更多选择。由于这两个靶点之间的协同作用比较清晰,因此研发热度相对较高,国内外至少 6家企业同时 在推进,其中进度最快的是 Amivantamab,正在开展临床 II期。虽然靶点相同,但各个企业在 双抗设计上有所区别。例如,Amivantamab(强生)通过引入突变减少轻重链错配,而 MCLA-129 (Merus/贝达)通过使用共同轻链减少错配。相比这两款双抗都是单价结合抗原,岸迈生物的 EMB-01 采取了 4 价(2+2)结构,理论上能够加强抗原和抗体的结合能力。不同表位阻断人表皮生长因子受体 2(Her2)的表达对细胞增殖、分化、迁移和凋亡起到重要调节作用,该 基因的过表达与许多上皮细胞癌症的发生和恶化关系密切,目前在乳腺癌、卵巢癌、胃肠道癌 症和肺癌里都发现了 Her2 过表达的情况。此外,Her2高表达的肿瘤表现出强的转移能力和侵 润能力,对化疗的敏感性也较差。赫赛汀 (曲妥珠单抗) 是一种靶向 HER2 的单抗,能竞争性 结合 HER2受体,阻断下游通路激活。但大部分初始接受赫赛汀治疗有效的病人常在短期内出 现耐药,主要原因是尽管阻断了 HER2 通路,但 HER2 可以和其他家族成员(HER1,3,4)形 成二聚体激活下游通路。帕捷特(帕妥珠单抗)是另一款 HER2单抗,与赫赛汀的结合位点不同,其主要是跟 Her2 蛋白的 CR1 区域结合,阻止 Her2 与其他家族受体形成二聚体,进一步 阻断下游通路。帕妥珠单抗+曲妥珠单抗具备协同效应,其联合疗法在临床上也体现较好疗效。HER2-HER2 双抗的理论基础主要是曲妥珠+帕妥珠联合疗法的成功。该类双抗通过同时结合两 个非重叠的 HER2表位,实现对于 HER2信号通路的更完整的阻断。这种独特的设计可形成多 种作用机制,包括双重阻断 HER2信号、增强结合并去除细胞表面的 HER2蛋白、强有力的抗 体效应子功能,提高肿瘤细胞杀伤作用等。目前国内在研的主要有康宁杰瑞的 KN026,以及百 济神州与 Zymeworks 合作的 ZW25,类似机制的还有 Merus 的 MCLA-128(HER2 x HER3)。靶向肿瘤生长环境肿瘤的生长需要血管供给营养以及微环境抑制免疫细胞,靶向肿瘤生长必需品也是杀伤肿瘤的 重要机制之一。抗血管生成主要是通过同时阻断两个或多个血管生成的通路,例如 VEGF、 VEGFR2、DLL4 等,来增强抗血管生成的效果,从而使癌细胞缺乏氧气和营养而死亡。目前 比较热门的抗血管生成靶点组合有 VEGF x DLL4,已有三家推进临床,结构各不相同。此外, 肿瘤会通过表达免疫抑制因子(如 TGFβ、CD73)和招募免疫抑制细胞等方式,实现免疫逃 逸。为加强免疫治疗效果,部分双抗被设计用来抑制肿瘤微环境,增强免疫细胞杀伤。2.2.3 免疫细胞激活机制改善单药毒性较大及无响应的问题伴随免疫疗法的研发推进,近年以 PD-1 单抗为代表的药物取得突破性进展,已成为肿瘤治疗的重 要手段。然而,免疫检查点单抗药物的临床效果较为有限,患者中的应答率仍然较低。因此,以联 合用药产生的协同效应为理论基础,靶向 2 个免疫细胞表面抗原的双抗药物成为研究热点,旨在加 强免疫细胞肿瘤识别杀伤作用。按照靶点机制,该类双抗可以分为松刹车+松刹车(作用于两个免疫 检查点)、松刹车+踩油门(作用于一个免疫检查点和一个免疫活化靶点)。由于目前多数企业具备相 应的免疫检查点抗体药物研发管线,因此在此基础上设计构建该类双抗速度相对较快。松刹车+松刹车免疫检查点单抗的联合疗法在多个临床实验中已经展现出其强于单药的治疗效果,由于具备理 论基础,该机制成为较为热门的双抗研发方向。与单药的联合疗法相比,双抗的形式有望进一 步提升安全性。例如,此前 CTLA-4抗体伊匹木单抗由于其较大毒性,在临床中应用较为受限, 而通过设计高 PD-1 亲和力、低 CTLA4 亲和力的双抗,能够尽量保障药物在促进浸润 PD-1/CTLA4 双阳性淋巴细胞激活的情况下,同时减少 CTLA4 对外周 T细胞的结合,提高临 床安全性。目前国内进度较快的品种主要是 KN-046(康宁杰瑞)和 AK-104(康方生物)。临床数据显示,与联合治疗相比,双抗展现出相似甚至更好的治疗效果,且改善了部分靶点药物单药毒性较大的问题。此外,相比生产两个单药,部分双抗的成本相对更低,患者用药费用也有望进一步下降。而对于单抗治疗失败的患者,双抗也呈现出一定效果,有望成为免疫检查点单抗药物治疗失败或复发患者的选择。免疫活化靶点由于其毒性较大,此前单抗研发较为受阻,而双抗可以使得其激活效应局限于肿 瘤环境,特异性更强,从而在提高病人抗肿瘤免疫反应的同时降低这类治疗中伴随的副作用。 例如科望生物从 Inhibrx 引进的 ES101(PD-L1 x 4-1BB)。4-1BB 作为免疫激活剂单药使用时 会出现较严重肝毒性,该款双抗通过设计成上面是 PD-L1 下面是 4-1BB 的 4 价抗体,使得双 抗要先与 PD-L1 结合产生触合效果,才能激活 4-1BB,保障其肿瘤环境中发挥作用,大幅提高 安全性。I 期临床中,该款双抗也表现出相比使用 4-1BB 单药显著降低的肝毒性。2.2.4 促进蛋白形成功能性复合体利用双特异性抗体两个抗原结合臂可以结合不同抗原的特点,两个抗原结合臂分别结合两种特定蛋 白分子,形成功能性复合体,从而促进完整的级联反应,激活下游通路。利用该种复合体给药,可 以减少机体内排斥反应,提高临床治疗效果。目前已上市的 Emicizumab(凝血因子 IXa x 凝血因子 X)就属于这个机制,用于治疗血友病。血友 病是凝血因子 VIII 缺陷性疾病。FVIII 的作用是活化后把 FX和 FIXa 连在一起,促进 FIXa 对 FX的 激活。Emicizumab被设计为可以同时靶向桥联 FIXa 和 FX,通过模拟替代 FVIII,促进凝血酶的产 生,降低血友病患者的出血率。2.2.5 细胞桥接机制最为热门,国内更多布局免疫目前在研的 218款双抗药物中,大部分属于细胞桥接作用机制,约占 43%。从国内外管线布局情况 来看,我国企业在免疫细胞靶点领域中的布局热度较高,管线数量是全球的一半。从研发格局来看,由于双抗的靶点选择较多,因此研发布局整体呈现分散的态势,尚未形成明显的 竞争格局。其中,几个单抗研发被证实有效的靶点在双抗中也较为热门,包括 CD19、CD20、CD33、 BCMA 等血液瘤靶点,以及 EGFR、HER2、VEGF 等实体瘤靶点。在这些管线中,大部分项目仍处于持续推进的状态,但由于新药研发风险较高,部分项目也出现终 止或失败的情况。2021年 1月 20日,Merck 宣布终止 PD-L1/TGFβ双抗 Bintrafusp alfa(M7824) 的肺癌 III 期临床试验,原因是其疗效难以击败 Keytruda 单药达到临床终点。而此前的单臂临床数 据显示,M7824在治疗 PD-L1阳性 NSCLC患者中,ORR达到 37%,而在 PD-L1高表达的患者群 体(肿瘤细胞 PD-L1表达≥80%)中,ORR高达 85.7%。随后,公司又于 2021年 3月 16日宣布 M7824 治疗胆管癌的 II 期临床未达到主要终点,患者 ORR 仅为 10.1%。PD-L1/TGFβ作为双抗热门靶点 之一,全球有多个企业在推进研究,其中国内恒瑞医药和普米斯的同靶点双抗已进入临床阶段。详见报告原文。(本文仅供参考,不代表我们的任何投资建议。如需使用相关信息,请参阅报告原文。)精选报告来源:【未来智库官网】。
 带水云
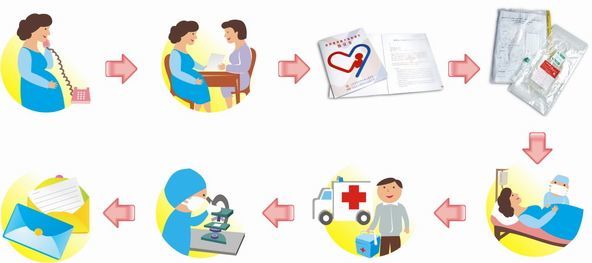
带水云江西抚州-1000吨血液制品智能工厂建设项目可行性研究报告
(一)项目基本情况公司自成立以来一直从事血液制品的研发、生产和销售,经过 20 多年的发展,公司 已发展成为我国血液制品行业的领先企业之一。 我国人口基数大,近年来, 随着社会步入老龄化、血液制品适应症不断增加和医疗保障体系不断完善,血液制品行业呈现快速发展态势。根据海通证券研究报告,预期 2015 年至 2019年的复合年均增长率为 22.4% ,市场规模有望于 2019 年达到 546 亿元。在良好的行业发展环境下,公司抓住浆源拓展和新产品研发两条主线,实现快速增长,生产规模快速扩大。在浆源拓展方面,公司由 2012 年上市时的 5个单采浆站增至目前的 10 个,加上原有浆站浆源的拓展,带动 2015 年和 2016年采浆量分别较上一年度增长 33.29%和 45.36% ,预计 2019 年采浆量将增至 500吨以上。在新产品研发方面,新产品人凝血因子Ⅷ、人凝血酶原复合物获得临床试验批准,在巨细胞病毒特异性免疫球蛋白、呼吸道合胞病毒特异性免疫球蛋白等新产品的研发方面取得良好的进展。面对采浆量的快速增加及新产品研发的良好进展,公司现有产能及生产条件已不能满足未来发展的需要。对此,公司本次 1000 吨血液制品智能工厂项目拟投资 136,011.50 万元,在现有业务的基础上,一方面提升生产能力,与未来采浆量的增长形成有效配合;另一方面,建设智能化工厂,采购现金的生产工艺,实现生产过程的全自动化控制, 满足未来巨细胞病毒特异性免疫球蛋白、呼吸道合胞病毒特异性免疫球蛋白、人凝血酶原复合物等新产品的需要。(二)项目实施的必要性1、 供需失衡是我国血液制品行业的基本特点血液制品作为血液的替代品,和其他药品的相比,具有明显的特殊性,一是在原料来源上,健康人血浆是唯一的原料来源,而设立单采浆站需要由省级卫生管理部门审批;二是国家限制血液制品的进口, 1985 年我国禁止进口人血白蛋白以外的血液制品, 2007 年允许进口重组人凝血因子 VIII, 除此之外的其他血液制品均不得进口;三是政府高度监管,行业进入壁垒高, 2001 年 5 月国务院办公厅发布的《国务院办公厅关于印发中国遏制与防治艾滋病行动计划(2001—2005 年)的通知》中规定,国家实行血液制品生产企业总量控制,加强监督管理,从 2001 年起,不再批准新的血液制品生产企业。鉴于上述血液制品的特殊性,我国血液制品行业长期处于供需失衡的态势,根据《中国输血行业发展报告(2016)》,我国进口人血白蛋白比例已由 2011 年的 47.70%上升至 2015 年 59.40% 。 如何扩大各种制品生产规模,提高血浆资源和采浆资源的利用率,缓解供需紧张是我国血液制品行业面临的重大问题。 为此,国家一直鼓励血液制品企业做大做强,满足人民对血液制品日益增长的需求。 作为血液制品行业的领先企业之一,公司本次利用募集资金建设 1000 吨血液制品智能工厂项目将大幅提高生产规模及宝贵血浆资源的利用率,为我国卫生事业的安全贡献力量。2、采浆量的快速增长将导致现有产能不足良好的浆源拓展能力是公司的核心竞争力之一,公司在新设浆站和现有浆站挖潜两方面均具备较强的竞争优势。 在新设浆站方面,国内对新设浆站设立了严格的准入标准,公司行业内少部分具有新设浆站资质的企业之一,且在新设浆站方面取得良好进展;在现有浆站挖潜方面,公司建立了一整套浆源管理办法并付诸实施,保障现有浆站采浆量稳中有增。目前,公司正大力开展浆站拓展工作和,预计在 2019 年浆站数量可达 13个,年采浆量可达 500 吨以上; 2024 年采浆量可达 1,000 吨以上。 公司现有生产车间于 2007 年 11 月 开始建设,设计理论产能为 500 吨,随着采浆量的快速增长,已不能满足未来的投浆量需求。3、医药行业监管的特殊性需要公司提前规划新厂房建设药品的使用直接关系到人民的生命健康,因此国家在行业准入、生产经营等方面制定了一系列的法律、法规,以加强对医药行业监管。药品生产企业出必须具备《药品生产许可证》外,还必须根据《药品生产质量管理规范》对具体生产设施及生产环境进行 GMP 认证,且 GMP 的标准会日趋严格。 而血液制品以健康人血浆为原料,对质量和安全性,特别是病毒安全性要求极高对此,与一般工业生产企业相比, 血液制品生产项目建设时间长,审批流程多, 本次募投项目建设期长达 3 年。 因此, 公司结合采浆量的增加趋势及新产品研发的进展, 必须提前规划 1000 吨血液制品智能工厂项目的建设,不仅与原有生产车间做到有效衔接,同时与采浆量的增长形成有效配合。此外,面对信息化技术的发展,智能化已成为提高生产工艺和生产效率的趋势,根据国务院发布的《关于促进医药产业健康发展的指导意见》和 “十三五”《医药工业发展规划》,明确提出到 2020 年医药生产过程自动化、信息化水平显著提高,大型企业关键工艺过程基本实现自动化,制造执行系统(MES)使用率达 30% 以上,建成一批智能制造示范车间。公司本次募投建设项目 顺应行业智能化发展趋势及国家产业政策,使生产过程实现智能化控制,进一步提高生产效率和产品质量。(三)项目的实施基础和优势本次项目对现有血液制品业务的升级和扩展,是推进公司发展战略的举措。公司经过 20 多年的血液制品经营积累, 具备本次募投项目的实施基础和优势:1、 良好的浆源拓展优势血液制品企业的主要竞争力由原料血浆的投浆量决定,投浆量决定于血浆采集量,而血浆采集量决定于浆源拓展能力,故浆源拓展能力是目前血液制品企业的核心竞争力所在。根据国家对设置单采血浆站的相关规定,国内对新设浆站设立了严格的准入标准,公司 具备行业内少有的新设浆站资质,同时作为江西省唯一一家血液制品生产企业, 存在一定区域垄断优势。近年来,公司在新设浆站及现有浆站的浆源拓展方面,均取得良好进展,为未来的持续快速发展奠定了良好基础。2、 丰富的产品线优势血液制品生产企业的产品线越多代表每类血液制品分摊的血浆成本越低,产品具有更强的成本优势,同时也代表了企业产品拥有更强的差异性,因而产品线是否丰富在很大程度上代表了企业能否在原料血浆供应紧张的局面在未来逐步得以缓和的情况下奠定竞争优势。公司目前拥有白蛋白、免疫球蛋白和凝血因子 3 大类 7 个品种 21 个规格的产品,是全国较少的三类产品齐全的企业之一。同时,产品结构合理,人血白蛋白的销售占比逐年下降,静注人免疫球蛋白和纤维蛋白原等产品已逐渐成为主导产品。在新产品研发方面, 人凝血因子Ⅷ、人凝血酶原复合物获得临床试验批准,在巨细胞病毒特异性免疫球蛋白、呼吸道合胞病毒特异性免疫球蛋白等新产品的研发方面取得良好的进展。3、技术研发优势凭借在血液制品等细分领域的技术优势,公司为国家高新技术企业、建有省级企业技术中心和江西省血液制品工程研究中心,并设有博士后科研工作站及院士工作站,与复旦大学共建“复旦-博雅制药工程联合实验室” ,具有较强的技术优势。截至 目前,公司在血液制品方面共取得 8 项发明专利,涵盖人血白蛋白、静注人免疫球蛋白、人纤维蛋白原、人凝血酶原复合物、人凝血因子Ⅷ等产品。公司先进的产品制备方法和工艺控制水平使公司具有良好的收得率,公司采用低温乙醇法结合层析工艺生产静注人免疫球蛋白,在保证质量的前提下,较单纯的低温乙醇法具有更高的收得率,处于行业领先水平;而公司采用自有专利方法制备纤维蛋白原,较其他企业有更高的收得率,市场份额亦位居市场前列。4、管理团队优势公司拥有优秀、稳定的管理团队,核心管理团队及关键技术人员未发生重大改变,平均任职年限在 10 年以上,均拥有丰富的血液制品行业及企业管理实际经验;同时,公司核心管理团队都持有公司股份,良好的激励机制和企业文化氛围使公司克服了人才不稳定、核心人员易流失的通病,充分发挥了民营企业良好的长效激励机制。长期以来,公司的核心管理团队结构稳定、风格稳健,强调公司可持续发展,注重核心竞争力的提升,并结合企业特点,形成了系统的、行之有效的经营管理模式,公司在成本控制能力和质量管理水平、浆源开拓能力和研究开发能力等方面都处于行业先进水平,有效提高了公司的利润率和盈利能力。(四)项目实施主体项目由公司作为实施主体,本次募集资金到位后,公司将使用募集资金建设该项目。(五)项目建设的主要内容本次项目投资总金额为 136,011.50 万元,其中固定投资 121,814.23 万元,占比 89.56% ,主要用于场地建设、设备采购及安装事宜、基本预备费等;铺底流动资金 14,197.27 万元,占比 10.44% 。(六)项目经济评价本项目建设期三年,投产后可实现年均营业收入达 240,380 万元,税后财务内部收益率 33.05% ,税后静态投资回收期 6.15 年, 具有较好的经济效益,并具有一定的抗风险能力。(七)项目所涉报批事项本项目 实施地位于抚州市高新技术产业开发区, 公司与抚州市国土资源局高新技术产业开发区分局签署了《 国有 建设用地使用权出让合同》(3620170813002K), 土地使用证正在办理过程中; 同时, 项目 已在抚州高新技术产业开发区经济发展与科技创新局完成项目备案(备案号:抚高新经备案[2017]6 号)。 除此之外,对于涉及我国环保部门的报批程序,公司将根据募集资金投资项目的前期准备情况,向有关政府部门提交相关材料,办理相关报批手续。
 折杨
折杨医药行业点评报告:2月血制品行业批签发数据点评
日前,2021 年2 月血制品批签发数据基本公布完毕。2 月,我国血制品新增批签发618.1 万瓶,同比下滑48%,环比下滑12%。前2 月,血制品共实现批签发1319.8 万瓶,同比下滑32%。重点品种静丙、人血白蛋白、人凝血酶原复合物、人纤维蛋白原批签发量同比都有较大幅度下降人血白蛋白2 月份批签发286.2 万瓶,同比下滑58%。其中进口白蛋白批签发172.9 万瓶(-63%),国产白蛋白批签发113.2 万瓶(-47.5%)。前2 月,进口白蛋白的批签发量持续降低,合计共批签发434.4 万支,下降44%。我们认为进口白蛋白批签发量的走势值得重点关注。由于去年海外疫情的持续,进口白蛋白的供给偏紧有望在今年陆续传导给国内。若进口白蛋白持续供给紧张,国内白蛋白价格存有一定的上涨空间。静丙方面,2 月份共批签发静丙65.95 万瓶,同比下滑-67%。前2月静丙共批签发170.8 万瓶,同比下滑-47%。除泰邦生物外,几大血制品上市公司静丙批签发量都有一定下降。特免方面,2 月狂免、破免及乙免分别批签发169.3 万瓶(+19%)、45.7 万瓶(-10%)及10.1 万瓶(+7%)。因子类产品方面,2 月人凝血因子(Ⅷ)、纤原及人凝血酶原复合物分别批签发12.1 万瓶(+123%)、7.9 万瓶(-37%)和6.3 万瓶(-49%)。前2 月,人凝血因子(Ⅷ)、纤原及人凝血酶原复合物分别批签发19.1 万瓶(-56%)、18.1 万瓶(-8%)和11 万瓶(-40%)。虽2 月人凝血因子(Ⅷ)1 月批签发量同比大幅提升,但前2 月批签发量仍同比下滑超过50%。从上市公司看,天坛生物白蛋白批签发量前2 月同比增长27%,静丙、狂免批签发量同比分别下滑11%和31%。华兰生物前2 月人血白蛋白、静丙的批签发量下降较多,同比下滑-76%和-67%。双林生物前2 月除静丙批签发量有个位数下滑外,其余品种批签发量均有一定增长。前2 月博雅生物白蛋白批签发量和纤原批签发量分别同比增长26%和91%。上海莱士2 月除狂免和破免批签发量同比增长外,其余品种均有一定程度下滑。卫光生物2 月仅白蛋白、狂免和纤原实现批签发,均呈现一定程度下滑。整体看,我国血制品批签发量在今年前2 月呈现较明显的下降,有春节放假及高基数等多重影响。我们认为行业需求稳定增长,在血浆资源供给偏紧及行业多年去库存背景下,供需关系演变值得重点关注,特别是今年以来进口白蛋白批签发量下滑较为明显。建议逢低关注以天坛生物、华兰生物为代表的行业龙头。风险提示:疫情影响超预期;行业监管政策进一步收紧;医保政策压力;行业事件性负面冲击;上市公司业绩增长低于预期;国内外经济形势持续恶化风险;国内外市场整体系统性风险。(文章来源:国开证券)
 导盲犬
导盲犬巨·研究|疫情提升血制品需求 这类股长期上涨空间大
行业研报看不懂、行业趋势不会把握……不用担心,巨丰投顾“巨·研究”来帮助。每月中旬、每个交易日4点,这里有行业、公司的跟踪分析,百家之长汇聚一堂、再叠加以巨丰独特观点,为您把控行业、个股投资机会……导读:武汉疫情牵动亿万人民的心,最新消息,新冠危重患者的特免血浆治疗效果明显,中国生物称,在目前缺乏疫苗和特效药的前提下,新冠肺炎康复者恢复期的血浆是临床特异性治疗最可及的资源。上文我们对血制品行业做了一些了解,今天我们主要看一下疫情的短期影响和行业长期发展推动力情况。疫情提升静丙需求 行业景气度望提升l静丙获批适应症有限,但 临床应用极为广泛静丙从每批次数万健康人血浆中分离提取而来,每个健康成年人在日常生活中要接触很多种病毒、细菌等微生物和食物、环境中的很多抗原物,血浆中相应有很多种抗体, 从数万人份血浆中提取的静丙抗体谱很广,种类达 107之多。在国内外市场,静丙正式获批的适应症数量均相对有限。其中,FDA 批准静丙 6 种适应症,分别为 B 细胞慢性淋巴细胞白血病、川崎病、免疫性血小板减少性紫癜、原发性体液免疫缺陷、多灶性运动神经病、慢性炎性脱髓鞘性多发性神经病;我国静丙的获批适应症主要集中在原发性免疫球蛋白缺乏症、继发性免疫球蛋白缺陷病、自身免疫性疾病。然而在经过国外 50 多年、国内 30 多年的临床应用后,除内科、外科、妇产科、儿科外,ICU 病房、干细胞移植、器官移植科室(肝移植、肾移植等科室)对静丙的使用量也逐年增加, 使用静丙治疗的疾病数量已达上百种,超适应症使用成为国内外的普遍现象。目前,各科室应用静丙的文献报告很多,但符合循证医学原则的资料不多;各国近年所用指南对静丙临床应用适应证的推荐等级也不一致。在众多适应症中,原发性免疫缺陷症、川崎病、免疫性血小板减少性紫癜等疾病被认为是静丙疗效确定的疾病;感染性疾病(特别是病毒感染性疾病)、免疫性疾病等被认为是静丙在临床中有一定效果的疾病。根据临床推荐用量,按平均体重 60kg 测算,静丙的单人单疗程用量普遍在 120g 左右,折合 48 瓶(2.5g/ 瓶),人均用量较大。▲静丙在临床应用中的主要适应症l疫情短期提升静丙需求在本次新冠肺炎疫情中,静丙先后被北京、深圳等地纳入诊疗方案。《北京协和医院关于“新型冠状病毒感染的肺炎”诊疗建议方案(V2.0)》推荐,重症患者依据病情可酌情早期使用静丙 0.25g/kg/d,疗程 3-5 天。《深圳市第三人民医院(国家感染性疾病临床医学研究中心)新型冠状病毒肺炎诊疗方案》推荐,根据患者临床症状、胸部影像学进展情况,在病情进展期建议使用人免疫球蛋白,有条件可用 IgM 型人免疫球蛋白。此外,根据公司公告信息披露,静丙还被应用于抗击新冠肺炎一线医护人员的预防性使用。本次疫情,静丙一方面被用于新冠肺炎患者治疗性使用,另一方面被用于一线医护人员的预防性使用,疫情明显提升了静丙的需求。安信证券通过系统测算,预计20Q1 全国新冠肺炎患者(仅考虑截至 2 月 11 日的累计确诊病例)和一线医护人员对静丙的理论需求量分别约为 30 万和 60 万瓶,合计约 90 万瓶。根据上述测算,在本次疫情的影响下,20Q1 我国静丙销量增速、血制品企业收入增速及利润增速有望分别提升 39pct、9.6pct 和 11.3pct;2020 年我国静丙销量增速、血制品企业收入增速及利润增速有望分别提升 7.5pct、2.5pct 和 4.2pct(因测算中存在较多假设条件,测算数据可能与实际情况存在较大差距,上述测算结果仅供参考)。长期看国内渗透率偏低大有提升空间白蛋白方面,从人均用量来看,我国白蛋白使用水平已与欧美国家水平比较接近,但鉴于我国是肝病大国,人均使用率可能高于其他地区。白蛋白未来的市场规模增长潜力,可能主要来自于对羟乙基淀粉替代所带来的渗透率提升、渠道扩张、总需求量提升及支付端开放等几方面。▲部分国家/地区血制品平均使用情况静丙方面,从人均用量来看,参考中检院及 MRB 数据,按照全国 13.9 亿人口,折算 2017-2018年国内静丙平均用量为 19g/千人;而美国和澳大利亚的静丙平均用量高达 210g/千人,加拿大为 78g/千人,日本为 35g/千人。我国静丙人均用量仅为美国和澳大利亚的 1/10、加拿大的 1/4、日本的 1/2,人均用量处于较低水平。长期来看,静丙的临床适应症广泛、循证医学验证疗效机理确切、不可替代性强等因素,决定了静丙的长期成长空间;而短期来看,目前静丙销售增长的驱动力,主要来自于医保支付端的放开以及企业学术临床推广及医生认知水平提高等。A股上市公司华兰生物(002007):国内血制品领先企业,疫苗&单抗为公司业绩添彩公司是国内首家通过GMP认证的血液制品企业,能从血浆中分离提取人血白蛋白等11个品种、34个规格的产品,生产规模、品种规格、市场覆盖和主导产品产销量均居国内同行业前列,是国内同行业中综合利用率最高和凝血因子类产品种类最为齐全的生产企业之一。2019年公司三、四价流感疫苗合计批签发1293万件,市占率分别达到公司47%、46%,合计占比46%,处于流感疫苗绝对龙头地位。按照三、四价流感疫苗近两年中标价均价分别为43元、108元来计算,2019年货值合计近11亿元。随着全球单抗品种的专利期逐渐临近,国内单抗药物发展空间广阔,未来10年将是我国单抗药物发展的黄金时期。华兰生物子公司华兰基因工程在2013年成立,开始布局基因重组与单克隆抗体领域。2018年,子公司取得了德尼单抗、帕尼单抗和伊匹单抗3个单抗的临床批件,目前共有7个单抗品种获得临床批件,2019年2月申请了贝伐单抗的临床批件申请。阿达木单抗、曲妥珠单抗、利妥昔单抗、贝伐珠单抗正在开展III期临床研究。未来随着单抗产品陆续上市,有望为公司贡献新的业绩增量。天坛生物(600161): 血制品行业国企龙头,公司业绩有望持续向好公司是国内血制品行业龙头。2019年静丙(2.5g/瓶)批签发量为296.9万瓶,同比增长10.7%,占总市场批签发量的24.6%,批签发量均领先于国内其他厂商;白蛋白(10g/瓶)批签发量为433.1万瓶,同比增长22.6%,占国产总批签发量的20.4%;同时公司特免批签发量也处于行业领先水平,尤其是乙免和破免(2019年批签发量分别占总批签发量的34.7%和22.5%)。天坛生物作为国内血制品行业龙头企业,随着新产能逐渐投产,公司具备新建产能投产+血浆内部调拨+层析静丙及凝血因子类产品逐渐获批上市等三重影响,展望未来3年,吨浆利润将继续呈现上升趋势;同时新冠疫情对血制品需求大增并导致采浆量受影响,血制品行业即将迎来供不应求,提价预期强烈,公司出厂价将呈现提升趋势及销售费用等同比下降,未来业绩有望进一步增长。博雅生物(300294):血制品和疫苗双轮驱动公司为跨越式增长的血制品龙头。博雅广东恢复生产后有望20年启动注入,博雅浆站将达37个(博雅12个+丹霞25个),未来采浆将达1300吨,有望实现从几百吨到千吨以上采浆的跨越式发展,成为国内血制品龙头之一。公司2019年 6 月公告拟收购罗益生物 60.55%股权,2019 年 12 月公司已完成以 1.75 亿元现金对罗益生物 11.68%股权的收购。罗益生物是我国 AC 流脑结合疫苗的龙头企业,围绕细菌多糖结合疫苗技术,在研产品储备优良,其中 AC-Hib 三联苗已处于III 期临床阶段。随着未来对罗益生物股权收购的完成,公司业务布局延伸至疫苗领域,公司业绩增长有望进一步提速。卫光生物(002880)公司产品销售良好,核心产品白蛋白和静丙销售增速均超过收入增速,去库存进展顺利。2019年白蛋白和静丙批签发增速分别为20%和10%,销售增速预计均在30%左右。从反映景气度的指标来看,公司销售费率下降,存货和应收账款周转天数缩短,应收款连续2个季度出现环比显著下降,存货连续2个季度出现同比下降,表明血制品终端销售良好,财务指标改善。总结来看,新浆站审批趋严导致全国采浆量增速从2017年以来持续下滑,2019年全国采浆9100吨,增速仅6%。而终端需求仍保持10%左右增长,供应增长低于需求增长,使得2017年大幅增长的血制品库存已经逐步消化,白蛋白库存恢复至正常水平,静丙库存明显下降。血制品行业恢复供需平衡状态,血制品恢复正常生产,2019年白蛋白和静丙的批签发和销售增速均有明显回升。需求方面,新冠疫情对血制品需求端拉动明显:静丙对新冠病毒的预防和治疗效果显著,企业库存已完全消化,市场需求仍在持续增长;98%的新冠病毒感染者血清白蛋白含量下降,对白蛋白的需求也有所增长。供应端采浆受影响;新冠疫情导致2020年采浆量受到影响。血制品将迎来供不应求,短期已显现出销售费用减少和账期缩短增厚利润,长期看很可能推动血制品价格上涨。(作者:赵玲 执业证书:A0680615040001)来源:巨丰投顾免责声明:以上内容仅供参考,不构成具体操作建议,据此操作盈亏自负、风险自担。
 姬神
姬神生物医药专题之单抗行业深度报告
如需报告请登录【未来智库】。1. 单抗行业进入繁荣期1.1. 海外生物药行业蓬勃发展,单抗占比最高近年,生物药凭借其药理活性高、特异性强、治疗效果好的特点,在全球医药市场 大放异彩。2018 年全球销售额前十的药品中,单抗和融合蛋白类的产品占据了八席。 其中,阿达木单抗实现销售额 199.36 亿美元,连续多年蝉联全球最畅销药物。上榜 单抗药物的适应症主要覆盖癌症、自身免疫疾病和眼科疾病等。2014-2018 年,全球生物药市场规模从 1944 亿美元增加到 2618 亿美元,年均复合 增长率 7.7%,高于非生物药市场增速。由于多个重磅单抗药物专利相继到期,生物 类似药进入快车道,市场规模从 2014 年的 17 亿美元增长至 2018 年的 72 亿美元, 年化增速超过 40%。生物药市场中,单抗是占比最高的细分类别。2018 年,全球生 物药销售额的 55.3%由单抗贡献。1.2. 我国单抗市场规模较小,发展潜力巨大2014-2018 年,我国生物药市场规模从 1167 亿元增至 2622 亿元,复合增长率 22.4%, 增速远高于全球水平。2018 年,生物药市场中单抗仅占比 6.1%,低于全球 55.3% 的水平,未来发展空间巨大。从需求端来看,老龄化加速、环境污染等因素造成中国居民疾病谱发生变化,癌症 和慢病发病率提升导致相关用药需求增加。我国从 2000 年左右开始正式步入老龄 化社会,根据联合国《2019 世界人口展望》报告,未来 30 年中国老龄化程度将进 入加速阶段,到 2050 年,60 岁以上人口占比将达到 35%以上。这个过程中,我国 居民疾病谱系将逐渐过渡到癌症和慢病。近十年来,中国恶性肿瘤发病率和死亡率保持着每年约 4%和 2.5%的自然增长率。 根据全球癌症负担估计结果显示,中国恶性肿瘤新发病例和死亡病例分别占全球恶 性肿瘤新发病例和死亡病例的 23.7%和 30.2%。同时,国内抗癌药物依然以化疗药 物为主,近几年占比虽然有所下降,但依然超过 50%。患者对副作用小、治疗效果 好的生物药需求较大。相比之下,美国恶性肿瘤死亡率在 1991 年达到峰值 215.1 人/十万人后以每年 1.5% 的速度逐渐下降,到 2016 年癌症死亡率仅 156.0 人/十万人,低于我国水平。单抗 等抗癌靶向药的临床使用是癌症死亡率大幅改善的因素之一。从支付端来看,随着我国经济稳定增长以及居民医疗保健意识的提升,医疗总支出 不断增加,越来越多的家庭能够负担起价格较为昂贵的生物药。另一方面,我国的 医疗保障体系也在逐渐加大了对单抗等创新药的支持力度。2017 年 7 月,人社部印发《关于将 36 种药品纳入国家基本医疗保险、工伤保险和 生育保险药品目录乙类范围的通知》 ,通过谈判将 36 种创新专利药物纳入医保乙类 目录,其中包括五个单抗药物和一个融合蛋白药物。2018 年 10 月,国家医疗保障局发布《关于将 17 种抗癌药纳入国家基本医疗保险、工伤保险和生育保险药品目录乙类范围的通知》,将包括西妥昔单抗在内的 17 种谈 判药品纳入医保目录乙类。谈判成功产品平均降价幅度超过 40%,在市场表现上,进入了国家医保的药品通过 “以价换量”的方式在第二年迅速放量。1.3. 重磅原研药专利相继到期,生物类似药如雨后春笋2013 年以来,多个重磅单抗药物专利陆续到期,全球生物类似药迎来大爆发。与原 研药相比,生物类似药具有类似的药效且更加便宜,药企能够凭借价格优势抢占原 研药市场,对患者而言也提高了药物可及性。欧盟在生物类似药上起步较早,2005 年就发布了《生物类似药指南》对生物类似药 进行了定义,即在质量、安全性和有效性上与已获批生物药高度相似的生物制剂, 并在 2006 年批准首个生物类似药 Omnitrope,截止目前共计有超过 30 种抗体生物类似药在欧盟获批。相较而言,美国专利制度更倾向于保护原研药。药企能够在制备工艺、使用方法和 剂量等方面设臵专利壁垒,变相延长专利保护期。截止目前只有 16 款单抗生物类 似药在美国获批,并且大部分类似药与原研药企业达成谅解,推迟了在美国市场的 上市。我国的生物类似药行业起步较晚,2015 年 2 月才首次发布《生物类似药研发与评价 技术指导原则》对 生物类似药、参照药物选择、研发和评价规则等进行了定义。2019 年 2 月我国首个生物类似药汉利康(利妥昔单抗类似物)正式获批上市。目前,国 内企业在研管线以热门靶点的生物类似药为主,研发进度较快,多个药物处在新药 审评阶段,有望在短期内陆续上市。由于我国单抗市场规模较小,原研药先发优势 并不明显,生物类似药有望凭借高性价比抢占市场。2. 研发能力是单抗行业核心竞争力2.1. 单抗是结构复杂的大分子治疗性药物单克隆抗体是由单一 B细胞克隆产生的高度均一、仅针对某一特定抗原表位的大分 子生物药。典型的抗体由四条多肽链组成,各肽链间由数量不等的二硫键相互连接。 每条肽链又可分为可变区(V区)与恒定区(C 区),其中可变区有三个区域的氨基 酸组成和排列顺序高度可变,称为高变区(HVR),由于高变区在空间结构上可与 抗原决定簇形成精密的互补,因而高变区又称为互补决定区(CDR),不同重链轻 链的 CDR 组合决定了抗体对抗原的特异性。2.2. 抗体药物的发展伴随技术升级 第一代单克隆抗体(monoclonal antibody, mAb)诞生于 1975 年,英国科学家 Milstein 和法国科学家 Kohler 将鼠源的 B淋巴细胞(B cells)同骨髓瘤细胞(Myeloma cells) 融合形成杂交瘤细胞(Hyridoma),单个阳性杂交瘤细胞经筛选和扩增后后将能够 不断合成单克隆抗体。这种方法制备的单抗特异性高,性质均一,易于大量生产,但由于人的免疫系统可以识别鼠源性单克隆抗体,产生人抗鼠抗体(Human anti-mouse antibodies,HAMA)反应将其中和,因此临床使用上有较大限制。人鼠嵌合抗体(Chimeric)是分子生物学和基因工程技术发展的产物。1984 年 Morrison 利用 DNA 重组技术,将鼠源性抗体的可变区与人源抗体的恒定区在基因 水平上连接在一起,成功构建了人鼠嵌合抗体。人鼠嵌合抗体最大限度的保留了鼠 源抗体的亲和力和特异性,显著改善了临床效果。嵌合抗体虽然可以部分解决异种蛋白的排斥问题,但其鼠源可变区依然可能会诱发 副作用,干扰疗效。为了进一步缩小鼠源抗体占比,CDR 移植技术得到了应用。 CDR 植入抗体也称改型抗体,利用鼠源单抗参与抗原识别的 CDR 区域替代人源抗 体的 CDR,使人源抗体获得鼠源单抗的抗原结合特异性。由于人源框架区 (Framework Region, FR)区也常参与作用,可能影响鼠源 CDR 区域的空间构型, 因此人源化抗体的抗原亲和力会有一定程度的下降。1985 年,Georgy Smith 在前人对丝状噬菌体分子生物学研究的基础上首先提出了噬 菌体展示技术(phage display technology)并首次建立噬菌体库,该技术的原理是从 人源 B细胞中分离抗体可变区基因,扩增抗体轻链和重链的基因片段,随后将体外 扩增的基因片段随机克隆形成组合文库;将基因组合文库噬菌体外膜蛋白融合表 达,展示在噬菌体颗粒的表面。最后用固相化抗原直接、高效地筛选出表达特异性 好、亲和力强的抗体基因序列,经体外加工形成全人抗体。阿达木单抗是利用噬菌 体展示技术开发单抗中最为成功的案例,2018 年全球销售额达到创纪录的 199 亿美 元。转基因小鼠技术在 1994 年被首次提出,其原理是将小鼠的抗体基因敲除,同时将 人源的抗体基因加入小鼠基因组,这样在抗原刺激下,小鼠将产生人源的抗体。目 前主流的转基因小鼠平台包括 Amgen 的 XenoMouse, BMS 的 HuMAb Mouse 等。转 基因小鼠技术的优势在于避免了基因工程抗体在构建时的复杂操作,而且由于小鼠 体内自发产生 B细胞,保持了抗体的亲和力成熟等过程,因此所获得的抗体特异性 较强。2.3. 单抗研发趋势2.3.1. 双特异性抗体双特异性抗体(bispecific antibody,bsAb)是指一类设计用于同时识别两种不同抗 原的大分子抗体。双抗有多种形式,从分子量相对较小的蛋白片段(仅由两个抗原 结合片段组成)到具有附加结构域的大型免疫球蛋白(IgG)样分子。双特异性抗 体最具吸引力的特征是其创造新功能的潜力,即合成出的新抗体具有在亲本或参照 抗体的混合物中不存在的活性,达到“1+1>2”的效果。目前共有超过 20 个商业化技术平台用于双特异性抗体的设计和制造, 2 款上市产品和大约 85 个处在临床研究阶 段的双抗药物。双特异性抗体的作用机理主要体现在空间效应和时间效应。空间效应:由于双特异性抗体拥有两条抗原结合臂,其中一条与靶细胞(Target cell) 表面标志物结合,另一条与效应细胞(Effector cell)结合,使得二者在空间上相互 靠近,从而激活效应细胞并介导定向杀伤。时间效应:双特异性抗体能够双靶点结合,即同时阻断两条信号通路,从而减少肿 瘤细胞通过转换信号通路或通过家族成员自身或不同成员之间的同源或异源二聚 体激活细胞内信号进行免疫逃逸。卡妥索单抗(Catumaxomab)由 Trion Pharma 公司开发,是全球首个商业化的双特 异性抗体药物,能够同时识别 T 细胞表面抗原 CD3 和癌细胞标志物 EpCAM,通过 体液免疫、激活细胞免疫等多方式清除癌细胞。卡妥索单抗 2009 年在欧洲上市, 用于治疗恶性腹水。在临床使用中,显著改善患者无穿刺存活率和下次腹腔穿刺的 中位时间,减少腹水症状。但由于药物理念超前,适应症患者人数限制等原因,销 售表现并不理想,2017 年因商业原因主动退出市场。博纳吐单抗(Blincyto)由 Amgen 开发,能够同时靶向 B细胞表面抗原 CD19 和 T 细胞表面抗原 CD3,介导 T 细胞对肿瘤 B细胞的定向裂解。2014 年经 FDA批准在 美国上市,用于治疗费氏染色体阴性的前体 B细胞急性淋巴细胞白血病。2018 年博 纳吐单抗全球销售额为 2.3 亿美元。艾美赛珠单抗(Emicizumab)由 Roche 开发,能够模拟活化凝血因子Ⅷ的辅因子活 性,桥连并促进 FⅨa 对 FⅩ的活化,进而导致凝血酶的生成显著增加,从而达到止 血作用。2017 年 11 月经 FDA 批准上市,用于 A型血友病的常规预防,在传统凝血 因子替代疗法外开辟了新的治疗手段。2018 年艾美赛珠单抗全球销售额为 2.24 亿 瑞士法郎。双特异性抗体作为一个新兴的研发细分领域,在 2014 年后进入了高速发展期。截 至 2019 年 3 月,全球共有超过 90 种双特异性抗体药物处在临床试验阶段。在 78 款抗癌双特异性抗体药物中,T 细胞表面标志物 CD3 以及免疫检查点 PD-(L)1 是热 度最高的靶点,针对的适应症包括血液瘤、非小细胞肺癌和乳腺癌等多种实体瘤; 非癌症双抗则主要针对感染性疾病和自身免疫学疾病,如 SLE,RA,糖尿病等。与海外企业类似,国内在研双特异性抗体靶点也以 CD3、PD-1 和 HER2 等为主。 其中,康宁杰瑞双抗药物 KN046 多个适应症处在临床 II 期阶段,进度领先。2.3.2. 抗体药物偶联物抗体药物偶联物(Antibody Drug Conjugate,ADC)是目前最具前景的抗体技术平 台,通过将具有细胞毒性的化疗药物通过合成连接段(synthetic linker)与单抗偶联。 ADC 药物兼具化疗药物杀伤力和单抗靶向性,被认为能够提升单抗药物在临床使用 的有效性。抗体药物偶联这一概念最早能够追溯到德国生理学家、诺贝尔奖得主 Paul Ehrlich 在 1913 年提出的“魔术子弹”(magic bullet)设想。但由于技术限制,直到 1958 年 才出现了第一代甲胺嘌呤偶联抗体药物用以治疗白血病。2000 年,全球首个商业化的 ADC 药物 Gemtuzumab Ozogamicin (Mylotarg)经 FDA 批准上市。Mylotarg 将吉妥珠单抗(CD33 抗体)与卡奇霉素(Calicheamicin)偶联 用于治疗急性骨髓性白血病,但由于偶联技术、靶向性、有效性等受限,辉瑞于 2010 年主动退出市场,2017 年 Mylotarg 经 FDA 评估后重新上市。Brentuximab vedotin(Adcetris)由西雅图基因和日本武田合作开发,将细胞毒性药 物通过连接子与布妥昔单抗偶联,靶向 CD30 并将药物定向富集于肿瘤细胞,2011 年上市用于治疗霍奇金淋巴瘤(nHL)。2018 年全球销售额 4.77 亿美元。Adotrastuzumab emtansine(Kadcyla,T-DM1)曲妥珠美坦辛偶联物由罗氏旗下基 因泰克开发,将 HER2 靶向药物曲妥珠单抗和化疗药物 DM1 偶联,2013 年上市, 是目前唯一获准治疗 HER2 阳性乳腺癌的 ADC 药物。2018 年全球销量 9.79 亿瑞士 法郎。第三代 ADC 药物的研发思路依然是发现杀伤性更强的小分子药物、设计多样化的 连接段合成路径,以及筛选全新的治疗性抗体。小分子药物的选择是影响 ADC 药物治疗效果的关键因素。目前大约三分之二的在 研药物使用微管蛋白抑制剂--奥利斯他汀(Auristatins)和美登素(Maytansinoids) 作为细胞毒素。微管蛋白抑制剂只对快速分裂的细胞有效果,并不会影响休眠的癌 细胞,使用后会有一定的耐药性。连接段(Linker)的优化是 ADC 药物发展的另一个方向。当药物处在血液循环中时, 为了降低脱靶效应所带来的毒性,连接段必须具有极强的稳定性,而当药物进入肿 瘤细胞中时,连接段又必须能够迅速释放出细胞毒素。第二代药物存在血液稳定性 差的问题,为了降低副作用不得不减少载药量。目前在研的三代药物大多从可裂解 性、可溶性和抗外排性等角度进行设计创新。2.3.3. 抗体工程改造除了与靶点结合从而阻断信号通路外,抗体还能够通过 Fc 段与效应细胞表面的 FcR 结合,介导 ADCC(抗体依赖的细胞毒性作用)和 CDC(补体依赖的细胞毒性作用) 效应杀死癌细胞。因此,可以通过重新设计抗体 Fc 段以增强其 FcR 结合能力从而 提升抗体杀伤效果,同时还能延长抗体的半衰期。目前对抗体 Fc 段进行修饰的主 要方法是糖基化改造和氨基酸突变。糖基化工程改造是实践中效果较好的一种技术路径。人 IgG 分子上存在一个极其特 殊的 N297 位点,该位点是否糖基化对抗体分子的生物活性以及对 FcγR 的结合能力 有显著影响。研究发现,N297 糖链上岩藻糖的移除能够提高Fc 对于 FcγRIIIa 的亲 和力以及 ADCC 活性,因此敲除岩藻糖转移酶的工程细胞株可以用来生产无岩藻糖 的 单 抗。 目前商业 化较好的 糖基 化工 程平台包括 Kyowa Hakko Kirin 的 POTELLIGENT 和罗氏的 Glycart。抗体 Fc 段的氨基酸突变是另一种抗体工程技术。Xencor 旗下的 XmAb 技术平台商 业化程度较高,与安进、强生、默克等国际医药巨头建立战略同盟,联合研发新一 代抗体。3. 国内单抗企业3.1. 恒瑞医药公司是我国创新药标杆企业,在创新药研发方面起步较早,研发投入持续增加。其 中,2018 年研发支出 26.7 亿元,占收入比重 15.3%,接近国际创新药企业水平。公 司核心业务为抗肿瘤领域,产品线除多西他赛、紫杉醇等经典化疗药物外,近几年 陆续有卡瑞利珠单抗、阿帕替尼、吡咯替尼等多个创新药上市。商业推广方面,公司深耕抗肿瘤领域多年,在学术推广上有着丰富经验,销售团队 规模超过 12,000 人,在行业中处于领先水平。研发管线方面,公司单抗药物布局以癌症为主,兼顾自身免疫疾病和代谢疾病,覆 盖 PD-1、VEGF、HER2 等多个热门靶点。其中,PD-1 单抗卡瑞利珠已经上市,首 个获批适应症为经典霍奇金淋巴瘤,后续食管癌、非小细胞肺癌、晚期肝细胞癌等 适应症上市申请已经受理,并且处在优先审评阶段。3.2. 复宏汉霖复宏汉霖由复星医药和美国汉霖科学家团队于 2009 年 12 月合资组建,主要致力于 生物类似药、生物改良药和创新型单抗的研发和产业化。产能方面,公司现有产能充足,徐汇生产基地设有共计 14,000 升(6 个 2,000 升和 4 个 500 升)的一次性反应器生产线。公司在上海的第二个生产基地于 2019 年 6 月 动工,未来能够进一步提升单抗产能。商业推广方面,由于原研药已经建立了一定的知名度,公司的生物类似药可以采取 对标原研药的策略,从而降低推广的难度和成本。公司四个核心产品的原研药物均 已进入国家医保目录,对应的生物类似药有望跟随进入目录,实现快速放量。公司在研管线丰富,包括生物类似药、创新生物药以及多种生物药的联合疗法,主 要治疗领域为肿瘤和自身免疫疾病。截止目前,复宏汉霖有 6 个生物类似物进入临 床阶段,覆盖靶点包括:CD20、HER2、TNF-α、VEGF、EGFR。其中,汉利康(利 妥昔单抗)于 2019 年 2 月成功上市,成为我国首个获批的生物类似药;HLX02(曲 妥珠单抗)与 HLX03(阿达木单抗)已获 NMPA 上市申请受理,目前处在优先审 评阶段。海外市场拓展方面,HLX02 在乌克兰、欧盟波兰和菲律宾等国同时开展国 际多中心 3 期临床试验,并于 2019 年 6 月获欧洲药品管理局(EMA)上市申请受 理。3.3. 君实生物公司成立于 2012 年,2015 年在新三板挂牌上市,2018 年于港交所上市,是我国首 家“3+H”企业。公司是研发驱动型企业,致力于创新药的开发和商业化,对药品 研发不断进行投入。公司在全球有三个研发中心,其中旧金山实验室和马里兰实验 室专注于肿瘤和自身免疫疾病机理研究和药物筛选,苏州研发中心则主要从事药品 功能学验证和工艺开发。 产能方面,苏州的吴江生产基地是公司中试临床药物生产,并将继续进行商业化生 产。基地目前产能 1,500 升,预计技术升级后将达到 3,000 升产能。公司临港基地 目前正在建设中,设计产能 30,000 升,一期两条生产线 12,000 升,将在 2019 年底 前投产。公司研发管线涵盖癌症、代谢疾病、自身免疫疾病和神经性疾病等多个领域。核心 产品特瑞普利单抗是国内首个获批的 PD-1 药物,除黑色素瘤二线方案外,公司还 在鼻咽癌、肺癌、肝癌等多个适应症上布局,临床进度位于国内企业第一梯队。JS002 是人源化的 PCSK9 单抗,用于治疗心血管疾病,目前正处于临床 II 期,是 国内首个提交临床申请的 PCSK9 单抗。UBP1213 是重组人源化抗 BLyS 单抗,用于治疗系统性红斑狼疮和其他自身免疫性 疾病。目前全球范围内仅有 GSK 的贝利木单抗获批上市,以及另外五款药物处于 临床试验阶段。公司的 BlyS 单抗是国内唯一获批临床的产品,目前处于 I 期临床阶 段。除了自主研发外,君实生物积极寻求外部合作。特瑞普利单抗和贝达的 Vorolanib、 石药的白蛋白紫杉醇、泽璟的多纳非尼等开展针对黏膜黑色素瘤、三阴性乳腺癌、 肝细胞癌等多个适应症的联合治疗,进一步丰富公司产品线。3.4. 信达生物 公司成立于 2011 年,2018 年在香港联交所主板上市,是一家致力于开发、生产和 销售用于治疗肿瘤等重大疾病的创新药企业。目前已经建立起了一条包括 21 个新 药品种的产品链,覆盖肿瘤、代谢疾病等多个疾病领域。其中核心产品信迪利单抗 于 2018 年 12 月获批,是国内第二个上市的 PD-1 产品,首个获批适应症为难治复 发的经典霍奇金淋巴瘤;还有 4 个品种进入临床III 期研究,3 个单抗产品上市申请 被 NMPA 受理,并均被纳入优先审评。产能方面,目前主要通过吴江基地的 3 个 1,000L 发酵罐进行生产,并达到 100%生 产成功率;二期生产线 6 条 3,000 升不锈钢生物发酵罐已经完成安装,预期投入运 营后总产能将达到 21,000 升;同时 4 条 15,000 升的生产线正在规划中,未来能够 对公司后续产品商业化生产提供充分支持。商业推广方面,公司拥有一支成员超过 350 人的成熟商业化团队,主要成员来自罗 氏,具备丰富的肿瘤药销售及推广经验。公司依托全面集成平台,在癌症和代谢疾病领域开发有 21 个创新药品种,覆盖 PD-1、CD20、VEGF、TNF-α 等经典靶点,以及 CTLA4、RANKL、OX40、PCSK9、 CD47等新靶点,同时围绕PD-1 和 VEGF布局单抗药物联用和双特异性抗体的开发。核心产品信迪利单抗获批经典霍奇金淋巴瘤,非小细胞肺癌、肝癌、胃癌、食管癌 等多个适应症处在临床后期,进度居国内 PD-1 产品第一梯队。除了与公司自主研 发的贝伐单抗类似药(IBI305)联用外,还通过外部合作的方式,与微芯生物的西 达本胺(HDAC 抑制剂)以及盛诺基的 SNG1005(紫杉醇与氨基酸短肽偶联化合物) 开展药物联用试验。IBI-305(贝伐单抗生物类似药) 、IBI-030(阿达木单抗生物类似物)、IBI-301(利 妥昔单抗生物类似药)等三个生物类似药上市申请已经受理,并且均获得优先审批 资格,在国内进度有一定优势。从 Incyte 和礼来引进 IBI-377(JAK1 抑制剂)、IBI-376(PI3Kδ抑制剂) 、IBI-375 (FGFR1/2/3 抑制剂)和 IBI-362(胃泌酸调节素类似物,OXM3),进一步加强在 代谢疾病领域的布局。3.5. 百济神州公司成立于 2010 年,2016 年、2018 年分别在纳斯达克和香港主板上市,是我国首 家“美股+港股”企业。公司专注于创新型分子靶向肿瘤免疫药物的发现、开发和商业 化。产能方面,公司在苏州和广州布局了生产基地。其中,苏州工厂主要负责小分子药 物商业化生产和大分子药物中试生产;广州工厂主要负责大分子药物的商业化生 产,设计产能 24000L,第一期工程在 2019 年完工。同时,公司与勃林格殷格翰达 成战略合作,借助其位于上海的基地生产公司重磅产品替雷利珠单抗。公司研发管线包括口服小分子制剂和单抗癌症药物。公司内部建立 6 个自主研发药 物,其中 PD-1 单抗替雷利珠、BTK抑制剂泽布替尼、PARP 抑制剂 Pamiparib 位于 临床后期。在外部合作上,公司于 2017 年收购新基公司 ABRAXANE(纳米白蛋白 结合紫杉醇) 、瑞复美(来那度胺)、 维达莎(注射用阿扎胞苷)等三款产品中国区 为期十年的商业化权利;同时与 Mirati Therapeutics、Zymeworks 等公司合作在全球 开展多个药物的 I/II 期临床实验。(报告观点属于原作者,仅供参考。报告来源:东北证券)如需报告原文档请登录【未来智库】。
 豳风
豳风人血白蛋白、静丙项目可行性研究报告-白蛋白进口占比略有下降
人血白蛋白、静丙项目可行性研究报告-白蛋白进口占比略有下降整体来看,2020 年 1-10 月血制品批签发保持平稳增长。其中,人血白蛋白批签发总量为 4884 万支,同比增长 18%,进口白蛋白占比有下降趋势;静丙批签发总量为 1076 万支,同比增长 10%。此外,我国血制品产品结构趋于多样性。在特免类产品中,虽然狂免(986 万支,同比-0.2%)和破免(505 万支,同比-6%)的批签发总量略有下降,但乙免批签发量为 176 万支,同比增长 16%。各种凝血因子类产品的批签发总量也都保持高速增长。(一)白蛋白&静丙批签发高速增长,白蛋白进口占比略有下降人血白蛋白:2020 年 1-10 月,人血白蛋白批签发总量为 4884 万支(以 10g/支规格折算),同比增长 18%。其中,国产人血白蛋白批签发总量为 1810 万支(同比+4%),占比为 37%;进口人血白蛋白批签发总量为 3073 万支(同比+28%),占比为 63%。2020 年 10 月,人血白蛋白批签发总量为 329 万支(同比+13%),其中国产人血白蛋白批签发量为 142 万支(同比+22%),占比 43%;进口人血白蛋白批签发量为 187 万支(同比+7%),占比 57%。2020 年 1-10 月,在进口企业中,杰特贝林(CSL)、基立福(Grifols)、百特(Baxter)、奥克特珐玛(Octa-pharma)占据主要进口市场份额,分别为 1137、660、656 和 566 万支,同比增速分别为+6%、+51%、+12%和+100%。国产人血白蛋白批签发量平稳增长。2020 年 1-10 月,共 14 家国产企业获批人血白蛋白。其中,天坛生物、泰邦生物、上海莱士、华兰生物占据主要国产批发市场份额,批签发量分别为 400、300、252 和 210 万支,同比增速分别为 5%、-13%、18%和 9%,市场份额分别为 22%、17%、14%和 12%。同时,值得关注的是,2020 年下半年以来,人血白蛋白的进口占比较上半年有略微下滑的趋势。海外疫情的持续蔓延可能导致海外采浆活动受到持续的影响,进口占比可能会持续下降,这为国产人血白蛋白释放了替代空间和价格弹性,也为国产人血白蛋白的产业发展创造了新的机遇。2015-2020年10月我国人血白蛋白批签发数据(万支)注:规格统一折算为 10g/支我国主要企业人血白蛋白批签发数据(万支)注:规格统一折算为 10g/支静丙:自 2019 年起,静丙批签发量逆势回升,保持高速增长。2020 年 1-10 月批签发共1076 万支(以 2.5g/支规格折算),同比增长 10%。其中,2020 年 10 月静丙批签发量为 72 万支,同比增长 4%。2020 年 1-10 月,总共 12 家国产企业获批静丙。其中,天坛生物、上海莱士、泰邦生物、华兰生物占据主要国产批签发市场份额,批签发量分别为 276、164、152 和 107 万支,同比增速分别为 7%、57%、-15%和-6%,分别占市场份额的 26%、15%、14%和 10%。此外,博雅生物、双林生物、卫光生物 20 年 1-10 月批签发增速也都超过 10%。2015-2020年10月我国静丙批签发数据(万支)注:规格统一折算为 2.5g/支我国主要企业静丙批签发数据(万支)注:规格统一折算为 2.5g/支近 10 年来,我国人民物质生活的改善,带动了持续不断的医疗升级需求,医药行业常年保持快于 GDP 增速的增长。医疗需求一方面来自于人口增加带来的基本医疗需求,另一方面来自于医疗升级需求带来的人均消费的提高。随着基数增大,我国医药制造业主营增速逐渐放缓,但仍然保持快于 GDP 的增速。同时,17、18 年收入增速提高与两票制下"低开转高开"有较大关系。但是今年以来,受疫情冲击影响,医疗机构作为高风险地区纷纷限制营业,其他传染病也因为防疫措施得到遏制,医药需求大幅下滑,医药制造业收入增速大幅回落并低于GDP 增速。中国医药制造业营业收入和 GDP 累计增速对比(现价计算)2019 年我国卫生费用占 GDP 比重 6.58%,而美国 2018 年占比则为 17.7%。近 10 年来,我国卫生费用占 GDP 比重基本呈逐年上升趋势,除了 2010 年略有下滑,其余年份较往年均有提升。不过对比美国,我国卫生费用占 GDP 比重依然较低。美国 2018 年卫生费用占 GDP 比重为 17.7%,大约是我国卫生费用占 GDP 比值的三倍。预计随着医疗升级需求的增长,我国卫生费用占 GDP 比重仍有提升空间。中国卫生费用(亿元)和占 GDP 比重美国卫生费用(亿元)和占 GDP 比重2020年以来医疗机构和医院业务量受新冠疫情影响大幅下滑2012-2015 年医疗机构业务量增速在 2012 年高增速的基础上逐步回落。在 2016-2017 增速短暂回升后,2017 至今医疗机构业务量增速低位运行。2019 年医疗机构业务量增速维持低位运行。2019 年全年医疗机构诊疗人次增长 4.9%,增速略高于 2018 年(+1.6%);1-11 月出院人次增长 2.6%,增速弱于 2018 年同期(+5.9%),我们认为原因主要系去年流感疫情爆发导致基数较大所致。按医疗机构划分来看,医院诊疗人次增速和入院人数增速(+7.3%,+5.8%)均高于基层医疗卫生机构(+2.7%,-1.9%)。医院中,公立医院诊疗人次(30.5 亿人次)虽高于民营医院(5.3 亿人次),但民营医院诊疗人次的增速(7.6%)高于公立医院(+7.2%),说明社会办医在国家政策的积极鼓励下正迅速发展。与此同时,民营医院的入院人数无论在数量上(3696 万人)还是增速上(+0.8%)都远低于公立医院(17487 万人,+7.0%),说明民营医院的诊疗现阶段主要集中在非住院的门诊等领域。2020 年 1-6 月医疗机构业务量增速大幅下滑,主要是受新冠疫情影响。2020 年 1-6 月医疗机构诊疗人次下降 21.6%,出院人数下降 16.6%,原因主要系受今年新冠疫情影响,人员流动停滞,医疗机构作为高风险场所缩减日常诊疗服务,同时今年的防疫措施也抑制了其他传染病的发病率。从单月数据来看,目前单月医疗服务数据同比降幅逐渐收窄,环比有所上升。6月份全国医疗卫生机构诊疗人次同比下降 9.7%,环比上升 5.9%;出院人数同比下降 2.5%,环比上升 3.0%。2007 年2020年6月全国医疗卫生机构总诊疗人次变化情况人血白蛋白、静丙项目可行性研究报告编制大纲第一章总论1.1人血白蛋白、静丙项目背景1.2可行性研究结论1.3主要技术经济指标表第二章项目背景与投资的必要性2.1人血白蛋白、静丙项目提出的背景2.2投资的必要性第三章市场分析3.1项目产品所属行业分析3.2产品的竞争力分析3.3营销策略3.4市场分析结论第四章建设条件与厂址选择4.1建设场址地理位置4.2场址建设条件4.3主要原辅材料供应第五章工程技术方案5.1项目组成5.2生产技术方案5.3设备方案5.4工程方案第六章总图运输与公用辅助工程6.1总图运输6.2场内外运输6.3公用辅助工程第七章节能7.1用能标准和节能规范7.2能耗状况和能耗指标分析7.3节能措施7.4节水措施7.5节约土地第八章环境保护8.1环境保护执行标准8.2环境和生态现状8.3主要污染源及污染物8.4环境保护措施8.5环境监测与环保机构8.6公众参与8.7环境影响评价第九章劳动安全卫生及消防9.1劳动安全卫生9.2消防安全第十章组织机构与人力资源配置10.1组织机构10.2人力资源配置10.3项目管理第十一章项目管理及实施进度11.1项目建设管理11.2项目监理11.3项目建设工期及进度安排第十二章投资估算与资金筹措12.1投资估算12.2资金筹措12.3投资使用计划12.4投资估算表第十三章工程招标方案13.1总则13.2项目采用的招标程序13.3招标内容13.4招标基本情况表第十四章财务评价14.1财务评价依据及范围14.2基础数据及参数选取14.3财务效益与费用估算14.4财务分析14.5不确定性分析14.6财务评价结论第十五章项目风险分析15.1风险因素的识别15.2风险评估15.3风险对策研究第十六章结论与建议16.1结论16.2建议附表:关联报告:人血白蛋白、静丙项目申请报告人血白蛋白、静丙项目建议书人血白蛋白、静丙项目商业计划书人血白蛋白、静丙项目资金申请报告人血白蛋白、静丙项目节能评估报告人血白蛋白、静丙行业市场研究报告人血白蛋白、静丙项目PPP可行性研究报告人血白蛋白、静丙项目PPP物有所值评价报告人血白蛋白、静丙项目PPP财政承受能力论证报告人血白蛋白、静丙项目资金筹措和融资平衡方案
 大宁静
大宁静医药行业深度报告:从核心到中坚、跨越“不可能三角”
(获取报告请搜索“未来智库”,登录下载。)2020 年医药行业投资策略1、仿制药:原料药-制剂一体化大势所趋、中国企业将赶超印度。一致性评价和带量采购对中国仿制药行业的影响类似于全球市场范围内的专利悬崖,中国仿制药企 业享受多年的政策红利一去不复返。趋势 1:原料药-制剂一体化大势所趋从全球比较来看:全球大型仿制药企业(尤其是印度)均呈现明显的原料药-制剂一体化模式,其优 秀的代表 Sun Pharma、Dr Reddy’s等市值达到 400-1000亿人民币。由于国内仿制药价格在集采的压力 下持续下降,薄利多销成为唯一可行的策略,因此足够大的市场尤为重要。这对于主要分布在长三 角地区、以出口起家的原料药企业延伸到制剂领域而言有天然的优势(同一种产品同时供应中国+ 全球市场,市场的量足够大)。其中优秀的企业因为多年出口欧美原料,生产线接受跨国制药巨头 们的审计,产品质量是其核心优势。但是这些原料药企业在转型制剂的过程中,其薄弱的销售能力 制约了其国内市场的开拓,因此出现了原料药企业做制剂往往是先在海外申报上市,再转国内申报 销售(华海药业、健友股份等)的情况。而现在:出口转国内申报的制剂品种等同于过一致性评价、 同时逐步推进的带量采购正好弥补了其天然的销售短板,从而使其国内制剂品种中标之后迅速放量。 从趋势来看,常规的仿制药一定会走向原料药-制剂一体化,未来仿制药的商业价值将大部分由原料 药构成(对于规模优势的企业而言是可以接受:卖仿制药就是赚原料药的钱)。趋势 2:中国原料药企业赶超印度的趋势在形成。从技术能力上来说,中国的原料药企业过往主要生产中间体,而印度的原料药企业主要生产 API 原 料药和出口欧美的制剂,中国企业是印度企业的上游。从制药产业的价值链上来看,中国企业是低 于印度企业的。但是现在情况正在发生变化,中国企业赶超印度企业的因素有 2个:1)技术水平提升。以往生产中间体,随后逐步升级到 API原料药,到近年来生产制剂出口欧美,再 到未来往高仿难仿、特殊剂型类升级,中国的原料药企业在全球制药业的价值链逐步提升。2)中国的特殊优势:CDMO(从标准化产品走向定制化产品)。CDMO是一种服务属性极强的柔性化 的工业生产,中国在 CDMO领域的优势高于印度,主要原因在于:中国政策环境对于 IP专利的保护 远高于印度、中国从业人员服务意识普遍高于印度(更加接受勤奋工作的加班文化)、中国具备更 加完整的产业链(化工产业链、CRO 产业链、风险投资体系等)。因此中国的 CDMO 行业出现合同 数量持续增加,供应份额大幅增加(由原来的备选供应商变为核心供应商),商业价值持续提升(中 间体到原料药)。2、创新药领域高强度投资推动 CRMO(CRO/CDMO)行业持续深化发展。我们判断创新药的投资强度的趋势应该考虑到两个方面:1、创新药本身的投资回报率;2、创新药 投资相对其他领域的相对吸引力。这两方面均决定了中国的创新药投资将会持续。首先:全球来看,一个 first-in-class新药的平均研发周期在 12-15年、投入为 21.7亿美金。而国内目前 的研发主要集中于 me-better、fast follow-on等,简单而言可以概括为跟随式创新,投资规模和风险(时 间 5-10年,投资规模数亿人民币)远低于全球创新药。虽然当前医保谈判使得创新药价格也是逐步 走低,但是其放量周期明显提前。考虑到中国巨大的市场规模,目前在国内投资创新药的回报率是 可以接受的,其最大的风险不在于研发成功率,而在于产品上市进度慢于竞争对手。其次:尽管投资创新药的失败概率较大,但从投资组合的角度来说,投资一定数量的创新药项目的 成功率是可以保障的。由于近几年重磅炸弹(PD-1、安罗替尼、西达苯胺、以 2 期临床数据直接申 报上市的艾氟替尼等)在国内商业价值的示范效应,加上港股市场和 A 股科创板投资退出渠道的完 善,从在全社会投资回报率下降的背景,投资创新药存在相对吸引力,因此吸引了社会资本跨行业 持续涌入行业,突出体现在:VC/PE融资额持续提升。而对已经在医药行业从业多年的产业资本来说(主要是医药行业上市公司),创新药研发又更是产 业环境迫使其做出的必然选择。由于中国传统的制药企业享受多年的政策红利,在仿制药集采的大 背景下,制剂企业受到的影响跟原料药企业完全相反(过往赖以生存的销售能力逐步弱化、过往的 高利润率持续下降),迫使其不得不走向研发创新。我们看到生物制药行业 PE/VC一级市场融资额在 2017-2019出现了爆炸式增长,加上 A股和港股上市 公司研发投入持续上升,这些钱会持续 2-3年投入到研发中去,所以新药研发的资金中短期以内都会 持续增长。创新药的投资在2-3年内仍将保持很高的强度,因此CRMO行业将持续维持较高的景气度。 除此之外,CRO 公司与风险投资机构呈现交叉持股的趋势,这会提高创新药投资的成功概率,这一 趋势值得重点关注。3、集采的判断:口服仿制药价格杀到成本线以下可能性不大,接下来的重点可能是注射剂和耗材。目前我们尚不能对仿制药最终的价格下定论,但是我们可以做逻辑推演。对仿制药而言,经过 2-3 轮的带量采购之后应该降到比较稳定的状态,利润也比较薄了。对医保局而言,进一步使其价格跌 到成本线不仅对于医保节约的最终目的毫无意义,更是有可能造成药品短缺,进而产生群体性社会 事件。因此我们更有可能判断:在口服仿制药的价格在集采进行到一定阶段之后,医保的主要精力 会转移到注射剂、高值耗材等利润丰厚的领域。4、优质的、高水平的医疗服务需求持续上升。当前的政策都指向一点:“低成本、广覆盖”。从支付端开看:药品和医疗服务的可及性正在提升,医 保也做好了老龄化时代全面到来前全民广覆盖的准备。但是被遏制的高端的、差异化的需求从何满 足?从另一方面来看:公立医院的医生作为医疗服务的主要提供载体,其收入水平受到集采的重要 影响,他们的利益如何保障?因此,需求和供给两方面都驱动了在公立医院、医保体系以外庞大的 自费、中高端、差异化医疗服务市场的发展。重新看回支付端:从商业健康险的筹资规模保持持续 快速增长。从社会办医的角度来看,诊疗方式固化、疾病认知较为充分、扩张能力较强的领域适合 投资,包括:医美、骨科、康复养老、细胞治疗、抗衰老、眼科、产科等,这些领域值得重点关注。5、生物制品成为当下良好的政策避风港之一。生物制品中,无论是血制品、疫苗或单克隆抗体等,随着负面事件的发生,目前监管的趋严和市场 也逐渐向着寡头格局靠拢。尤其血制品和疫苗进入集采降价的可能性非常低,因此从今年二级市场 的估值角度,板块 PE都已经达到甚至超过了 2017-2018年的水平,而这一趋势还在不断的强化。血 制品具备资源品属性,尤其当下受到政策影响供给端受限,龙头的规模和资源优势表现为估值溢价; 不同的是疫苗板块以产品和技术驱动,在国内预防免疫接种市场远未被满足的背景下,先发优势非 常明显,因此品种管线齐全、或自研大品种有望近两年上市的公司都受到市场的认可,给予较高的 溢价。6、本土医药企业龙头的命运:跨越“不可能三角”、与狼(跨国企业)共舞。趋势 1:本土医药企业龙头将与跨国药企进行更加激烈的竞争。不可否认:跨国医药企业巨头在中国的市场份额持续提升,对于中国企业的挤压比之数年前愈发明 显。不能否认的客观事实是:跨国巨头在中国市场受到带量采购的影响要远小于国内本土药企。由 于药审政策对于创新药的鼓励,使得全球创新药能够更快的进入中国,更快的进入医保准入,更快 的放量。进而我们看到多家跨国巨头中国区的业绩呈现加速的趋势。我们必须认识到:在全面扩大 对外开放的背景下,这一趋势只会愈演愈烈而不会倒退,跨国巨头与本土企业将长期呈现“亦师亦敌” 的关系。过去二十年,本土企业在与跨国巨头竞争的过程中采取跟随战略获得了长足的进步。在未 来,以大量牺牲本土医药企业为代价的基础上,少数优秀的本土龙头公司将逐步获得与外资对等的 竞争局面,形成“与狼共舞”的局面。趋势 2:跨越医药企业的“不可能三角”。我们大体可以认为对医药企业而言:优秀的产品管线、优秀的现金流、优秀的盈利能力,这三者很 难兼得,从而形成了医药企业的“不可能三角”。在过往的产业环境中,医药企业往往只需要满足其中 两个条件即可,其中一类企业满足:优秀的现金流+盈利能力。这一类公司依靠拳头品种获得极强的 盈利能力和优秀的现金流,但是在行业变局突然来临的情况下,受到了重大的打击。还有一类企业 具备优秀的产品管线,但现金流和盈利能力都比较差,这一类企业以港股创新型生物制药公司为主。 除了极少数公司如恒瑞医药、中国生物制药等,大部分本土企业都无法在长期市场检验中同时达到 这三个标准。而放眼全球范围,跨国医药巨头基本上全部符合这三个条件。这些跨国巨头经过数十 年甚至上百年的市场洗礼,是具备强大的能力去抢夺中国市场的。我们认为中国医药企业龙头的使 命就是要不断提升自身产品能力,跨越“不可能三角”,从而在更高层次上与跨国巨头进行竞争。7、投资策略:未来不悲观,投资机会有望扩散。纵向来看:经过今年的持续上涨之后,医药板块市盈率由去年年底的 26倍,提升到目前的 33倍(预 测法、2019 年)。整体估值处于历史中值水平,但是分化严重:市场认可度高的白马股估值可以达 到 50倍以上,个别股票能到 80-100倍,超越历史估值体系极限。而绝大部分医药股市场关注度低, 其中大量股票估值在 20 倍以下,出现估值和流动性双差的情况。从 PEG 的角度来看:板块增速在 15%-20%,平均 PEG处于 1.5-2之间,其中少数白马股的 PEG可以达到 2.5以上。横向来看:对应 2019年,A股医药板块市盈率 33倍(预测法)、美股医药板块市盈率(TTM)为 24 倍、港股医药板块市盈率(TTM)为 16倍。全球比较来看,港股医药板块具备相对吸引力。从外资 配置的角度来看,2019年是外资指数资金被动配置 A股比较集中的时期,加上 2018年就已经开始的 外资持续涌入,A股医药白马股基本上呈现外资持股高于内资公募的局面。展望 2020年,我们认为 在当前位置上,外资大规模主动加仓医药白马股的节奏变缓(但会持久),白马股估值提升的难度 逐步增大,2020年白马股的业绩增长更有可能成为驱动其股价上升的主要原因。机会逐步扩散:从核心到中坚的投资风格转换。每年回顾医药板块的表现,时常会发现意想不到的 机会。比如:2018-2019年核心龙头白马股持续上涨突破传统估值体系;2018-2019创新药的投资机会 带来 rNPV估值体系的认知;2019年的欧普康视、兴齐眼药超预期的上涨让市场认识到眼科市场的巨 大。同样的,展望 2020年我们并不悲观,因为人民群众对优质的医疗服务需求持续提升是不可逆的 趋势,即便政策压力再大,也会有受益的领域。而投资风格上来看:2016-2019 年一九风格演绎趋向 极致。实际上,从 2019年开始,我们已经察觉到市场风格逐步在从大市值白马股扩散到各个强势细 分领域的龙头,比如 CRMO行业、疫苗行业等。展望 2020年,我们判断这一趋势有望延续,甚至有 可能扩散到更大的热点题材范围如:科技属性比较强的医疗领域。因此我们也建议投资者加大对于 这些领域的布局。A股 2020年年度投资组合推荐标的:凯莱英、药明康德、普洛药业、迈瑞医疗、乐普医疗、华兰生物、昭衍新药、健友股份、 康泰生物。CRO 行业整体维持高景气度,细分赛道龙头公司受益医药行业发展模式重构,CRO 维持高景气度的需求基础坚实药企研发费用增长是 CRO繁荣的基础,我们认为,医药行业目前处于重大变革之际,药企研发投入 持续增长奠定了 CRO行业成长的需求基础。我们通过分析需求端不同研发主体(big pharma、传统药 企转型、biotech)研发支出情况、国内临床试验数量,认为:国内创新研发方兴未艾,不同类型药企 基于自身的需求选择不同程度的和 CRO公司合作,尤其是一级市场回暖、科创板推出,biotech能给 CRO 带来明显增量订单。鉴于 CRO能够降低成本、缩短研发周期、分散风险,预计 CRO整体的外包 渗透率进一步提升,行业景气度向上。重研发轻销售是未来趋势根据国家统计局数据,我国规模以上医药工业研发费用自 2011年 215亿元增长至 2018年 534亿元, 复合增速 13.87%,占收入比例 1.46%提升至 1.80%。A股医药行业(sw化学制剂、sw中药、sw生物制 品、sw医疗器械)2018年研发费用共计 390亿元,同比增长 32%,占收入的比例为 3.76%。2018年 A 股医药研发 top10研发费用共计 130.53亿元,占研发总体费用比例 30%,呈现明显的头部集中,龙头 恒瑞 2019年前三季度研发费用 28.99亿元,已经超过 2018年全年 26.7亿元。研发费用的增加是 CRO 行业繁荣的基础。自 2015以来,仿制药一致性评价、二票制、持续推进的药审改革、带量采购等重磅政策重构行业发 展逻辑,仿制药的“创新药”式销售模式不复存在,仿制药价格下降是必然趋势,药企为了保证持 续发展和稳定的盈利能力,主动或被动转型创新研发;同时,政策也从研发、生产和医保支付等多 个环节鼓励、支持创新研发。我国医药行业正处于“仿制药”向“创新药”战略转型期。不同类型 的药企基于自身不同需求进行研发行为,具体而言:1)以恒瑞为代表的 big pharma,为了保证其在行业的领头地位和竞争能力,创新研发是必然选择, 例如,2018年研发费用 27.6亿,同比增长 51.7%,近 3年来研发总体投入 56亿元。其在研管线众多, 大量的研发投入保证其管线顺利推进,其内部研发流程完善,但为了保证研发效率和降低成本,一 般会分拆不同环节的研发流程给 CRO,追求研发效率的最大化。2)以天士力为代表的中药龙头公司为例,中成药尤其是中药注射剂面临着降价或纳入辅助用药的风 险,为了保证企业的长久持续发展,必须在主业范围之外寻找新的利润增长点,天士力的战略定位 从现代中药标杆转变为现代中药-化药-生物药协同发展, 在新领域拓展研发经验尚不丰富,大概率 会借助 CRO等专业机构进行辅助,因此,新领域的研发外包渗透率较高。3)传统的仿制药公司,这类公司产品线以仿制药为主,受到带量采购冲击较为猛烈,创新转型的动 机较为充分,但由于创新研发管线较少,在研发的早期阶段可能存在研发经验不足,对 CRO的依赖 性较强。4)中小型仿制药公司同样会受到一致性评价、带量采购等政策冲击,但由于其资金、人才实力不足, 其研发意愿一般,可能会逐渐退出市场竞争。一级市场融资回暖 + 融资渠道拓宽, biotech 繁荣将为 CRO 带来明显增量Biotech公司在创新研发中发挥着越来越重要的作用,根据 FDA过往数年新药批准分析,全球销售额 前十大的药企新药审批份额下降,从 2009年占比 35%下降到 25%;更多的药物从小型/新兴公司获得 批准,其占比从 2009年 30%提升到 2018年 49%;而且大多数获批的药物都来自于或最初由规模较小 的生物制药公司开发,2014-2018 年总计 113 种获批药品(占获批总数的 54%)是通过引入或者并购 的方式取得的,其中,80个药物(占比 71%)源于规模较小的生物制药公司。Biotech一般起步于某个或少数的研发项目,多数 biotech 公司没有上市的产品进行销售,研发投入主 要依靠融资进行,因此融资额可以作为预判 biotech 繁荣度的先导指标。根据万得的 VCPE 库统计数 据,2018年国内医疗健康行业融资额 1,034亿元,同比增加 145.6%,其中制药、生命科技融资 562.18 亿元,同比增长 162%。医疗健康成为投资增长最快行业,并且投资整体成熟度在提升,投资方式已 经从之前广撒网变成集中资源,投资优势项目,更加倾向于技术驱动型领域投资,例如生物领域、 医疗器械领域交易次数占总融资事件的 30%以上。此外,港交所放开限制以及科创板的设立,相对 宽松的上市条件使得 biotech公司融资渠道拓宽,2018年至今,港股共有 8家 biotech上市,合计募集 210亿元;24家医药公司科创板上市申请获得受理。资本的青睐,将吸引更多掌握先进技术的团体或 个人创业,在资本的支持下能够更好的进行技术创新,促进行业的发展。由于 biotech公司的研发管线较少,整体资金实力、人才储备远不比大型药企,其往往专注于研发的 某个关键环节,其他环节对 CRO的依赖程度较高,因此外包渗透率较高。Biotech融资环境回暖, 能 获得更多资金进行研发投入,对 CRO发展有重要作用。假设港股融资的 biotech融资金额的 60%用于 研发,外包渗透率 50-70%,2019年为 CRO行业贡献 63-88订单金额;2018年医疗健康行业中制药行 业融资金额 562.18亿元,约 30%用于研发,外包渗透率 60-70%,预计未来三年为 CRO行业带来的订 单增量约为 101-118亿。临床试验项目增加明显,新药研发竞争激烈加快研发外包根据药物临床信息登记与公示平台数据统计,2018 年正在进行的 I-VI 临床试验项目数 818,较 2017 年同比增长81.78%,其中临床I期项目数量增长最快,为97.28%,其次是临床三期试验,增速为93.10%。 在 2018年所有的临床试验项目中,化药项目占比 56.96%、生物药占比 37.76%、中药项目占比 5.26%, 生物药临床试验数目增长是最快的,增速 122.3%,我们推测生物药项目高增长的原因可能和投融资 转暖背景下,biotech 创业潮相关。药企研发投入增加的背景下,预计未来同一领域的新药研发竞争 也愈加激烈,为了追求高效率的研发回报,预计有更多的环节和项目进行外包。综上我们认为,在医保控费趋严和精细化的背景下,鼓励创新、带量采购等行业政策重构我国医药 行业运行的模式,将从之前“销售”驱动逐渐转型为“研发”驱动,创新研发推动行业发展。对于 药企而言,在仿制药价格下降必然趋势下,为了保证持续发展和稳定的盈利能力,只有转型创新研 发,寻找新的利润增长点。研发投入持续增加为 CRO的繁荣发展奠定基础。同时,在盈利空间被压 缩的情况下,研发投入更加注重成本和效率,越来越多的药企和专业的 CRO机构合作,CRO的行业 的渗透率不断提升。目前国内创新研发方兴未艾,从进临床数量、一级市场融资额等先导指标来看, CRO/CDMO行业不存在景气度向下情况,内资药企的研发投入快速增加,将带动 CRO行业腾飞。CRO 细分赛道成长逻辑有差异,精选龙头医药创新研发是未来的重要发展方向,对药企而言,研发创新不是可选选项,而是必选方向(做创 新不一定成功,但不创新研发是坐以待毙),虽然研发成功率很低,但是在全社会投资回报率都在 下降的情况下,有一定成功概率的创新药投资会吸引资金持续投入,因此,作为创新研发产业链上 的“卖水者”,CRO/CDMO 行业必然长期受益研发创新大发展。从药企研发投入、临床试验数目、 一级市场融资额等先导指标来开,CRO/CDMO行业不存在景气度向下情况。我们看好 CRO行业高景 气度下各 CRO龙头公司在未来三年内业绩继续保持高增长,短期内可追踪的指标包括新签订单、在 手订单、产能等情况;中长期来看,不同的细分赛道驱动成长的核心动力略有差异,驱动力的差异 影响公司的未来业务布局和成长空间。早期药物发现环节 全球产业转移趋于稳定,龙头公司一体化布局拓展服务范围在上个世纪 90年代,我国的 CRO萌芽期在外企离岸外包的需求下萌发,并且主导了第一轮的高速成 长。凭借国内成本优势,外企的临川前 CRO业务开始向国内转移。1996-2003年,国内 CRO的萌芽期, 药明康德、尚华医学、博济医学、量子高科相继成立,主要承接临床前 CRO业务。经过将近 20年的 产业转移,目前药明康德和康龙化成分别在全球药物发现市场占据 3%和 1.7%的市场份额,位列全球 第二和第三。2014年-2018年,药明康德的核心业务药物发现业务(主要是中国区实验室服务)的复 合增速 26.49%,康龙化成核心业务实验室化学复合增速约 26%左右。作为全球药物发现的龙头公司, 两者的共同点都在于打造一体化的服务平台,药明康德致力于打造“一体化、端到端的赋能平台”, 从临床前 CRO 业务,向下游延伸至临床 CRO、CDMO,贯穿药物发现、临床前开发、临床试验及商 业化生产全产业链,从开端到终端,实现了药品从实验室阶段的分子发现到商业化阶段生产的全流 程覆盖。康龙化成公司致力于打造全流程、一体化的研发平台,实验室服务业务作为公司的基石业 务,能够为增量业务实现导流,例如,药物发现阶段的体内外生物科学 76%的收入来源于与实验室 化学的协同效应,78%的 CMC 收入来源于与药物发现服务(实验室化学和生物科学)的协同效应, 增资南京思睿(持股比例达 55.56%)和收购联斯达(持股比例 48%),进一步拓展临床服务能力。 我们认为,对于像药明康德和康龙化成较大体量的具备服务全球客户能力的 CRO龙头公司,未来的 更大的发展空间来自于服务能力和服务范围的不断拓展,全流程、一体化布局是趋势,国内市场同 时能够带来较大的业务增量。安评领域国内创新崛起推动快速发展,未来拓展服务领域和地域是打破成长天花板的关键安评是新药品进入最终临床试验和最终的批准前的必要程序和重要步骤,根据新药研发费用分布, 该环节费用约占整个研发成本的 15%左右,根据国家统计局数据,以 2018年规模以上医药工业企业 研发支出 534亿为基础,我国目前药物安全评价市场规模超过 80亿元。国内正经历创新意识觉醒, 创新生态加速发展,药企将进一步加大研发投入,根据南方所预测,预计未来 5年研发支出保持 15% 以上增长,药物安全评价市场规模增速跟药企研发支出增速保持匹配。2023 年药物安全评价市场规 模不低于 160亿,届时外包市场渗透率有望达到 50%以上,安评外包市场规模超过 80亿元。市场担 心药明康德作为巨头,对昭衍新药业务的冲击。我们认为:1)行业层面来讲,创新研发方兴未艾, 随着研发投入和外包渗透率的提升,市场竞争还没有恶化到价格战,不存在两家龙头不能共存的局 面。以安评市场龙头公司昭衍的2019年三季报来看,最显著的特点是公司预收款项较年初增长22.71% (反映新签订单情况),存货(反映未结课题)较年初增加(90.75%),这说明高行业景气度下公 司在手订单依然充沛,正处于消化订单的时期。 2)公司角度分析,昭衍在行业内积累了很好的口碑, 大药企追求效率和 biotech追求成功率,选择行业口碑。对于药明康德来说,其业务由不同的分公司 承担,从子公司经营成果角度来讲,不可能牺牲某子公司的利益,服务于其他公司。以全球 CRO 龙头公司之一 Charles River 的成长路径推演昭衍新药的发展空间,我们认为昭衍新药从 “存量增长”和“增量突破”两个维度保证业绩稳定和持续成长性,1)“存量增长”:安评业行业 受益于药企研发投入增加和 CRO外包渗透率提升,未来三年行业复合增长保持 20%以上增长,作为 安评龙头的昭衍市占率不足 5%左右,还有很大提升空间。公司新签订单、在手订单、产能保证了公 司未来 3年业绩仍能保持高增长。公司不断提升自身在安评领域的服务能力,提高客户黏性。2)“增 量突破”:我们认为一是海外客户的拓展,公司美国子公司昭衍加州今年在市场开拓有重大突破, 海外业务提供增量;公司收购 biomere,提升美国市场影响力和服务能力;二是公司在产业链业务横 向多样化和纵向延伸打破原有天花板,已公告进入药物警戒服务领域、药物临床试验领域;新拓展 业务还包括实验动物模型研究、非药物评价领域。临床 CRO市场规模弹性大,直接受益中国市场红利目前国内新药研发策略以 fast-follow为主,相对 best-in-class和 first-in-class等,研发的成功率较高,研 发项目推进的概率较高,当临床 2期项目进入三期后,计划入组病人数目有 5-10倍的增长,临床 CRO 数据统计工作剧增,目前国内创新研发早期的项目较多,随着研发进度推进,预计临床 CRO行业在 未来 2-3年快速增长。例如,2018年中国新增了 320项肿瘤临床试验,比 2017年的 205项增加了 115 项;这些试验涉及 28个瘤种,涉及 293个药物,生物药首次超过 50%;试验人数达到 49,517人,比 2016年和 2017年有较大增长,是 2017年 15,253的 3.2倍。临床 CRO的市场规模占比高于临床前 CRO 环节,在未来 2-3年的市场规模增速快于临床前环节,短期内市场规模增长爆发性强,相关公司的业 绩弹性较大,国内 CRO龙头泰格医药未来三年有望保持 35%以上的高增长。此外,临床 CRO相比临 床前 CRO,固定资产投入相对较少,属于绝对的轻资产运营模式,主要生产力是人员,灵活性相对 较好。国内 CDMO行业蒸蒸日上,全球影响力不断提升目前国内的 CDMO业务主要包括两大来源:一类是服务于新药产业链的更侧重“D”端的生产服务一 体化企业,另一类是以专利期内或过期专利药的 API中间体的生产为主的更侧重“M”端的原料药企。 受益于日渐明晰的全球产能向中国转移趋势以及国内创新药的蓬勃发展,这两类企业均表现出巨大 的发展潜力及良好的增长势头。我们认为,中国的 CDMO 有希望不断替代传统的欧美优势产能、并 超过先于中国发展的印度市场,成为未来 CDMO的最主要承接地区。现时期国外+国内两大动力驱动, 国内 CDMO企业处于高速成长期,看好各类型 CDMO企业趁行业大势迅速成长,在全球市场占有更 大的份额,并凭借各自差异化的竞争优势成长为所属领域一线企业。Top药企外包比例仍在提升,全球存量产能渐向中国转移医药生产外包行业已经从早期较简单的单纯产能承接(CMO)发展为具有较高附加值的 CDMO,对于 研发周期长、前期投入巨大、技术水平要求越来越高的创新药产业来说,CDMO 行业已经成为产业 链上不可或缺、且药企对其依赖度越来越高的环节之一。巨头药企剥离产能和外包意愿增加,新药研发对 CDMO 依赖度越来越高随着新药研发成本的持续攀升和投资回报率的不断下降,传统老牌药企为了降低药企的资本支出压 力,外包意愿在不断提升。2018 年这些指标仍在持续恶化,这将使得未来大药企的外包意愿继续加 强。根据 Deloitte的统计,2010年巨头药企单个新药的平均研发成本为 11.88亿美元;而到了 2018年,这 一数字已经高达 21.68亿美元,在不到 10年的时间里单药支出接近翻倍。而 2018年的研发收益率在 连续多年大幅下降的情况下,进一步从 2017年的 3.7%下降至仅有 1.9%。越来越大的研发投入和越来 越高的研发难度使大药企更加注重在成本端的控制,将生产等非核心业务转移至中国、印度等发展 中国家,可以大幅降低研发生产成本。一般而言,将生产外包,至少可降低约 30%的生产成本(视 外包地区的原料价格、设备价值、人员薪资情况有所不同)。近十年 FDA获批新分子药物的 API 外包比例能够很好的呈现这一趋势:10年间,FDA批准的新分子 化药的 API外包比例从 40%左右逐渐提升至目前 60%左右的外包水平,线性拟合的趋势线体现稳定增 长且有继续提高的趋势。由于创新药增量的外包比例更高,因此这个比例略高于药品原料药制造整 体外包比例。另外药品的产能建设属于重资产投入,建设周期长、变更缓慢,近年来“专利悬崖”以及新药迭代 速度的加快,对于产能的灵活性要求更高,专利到期或新的可替代药品上市都会造成原有品种产能 需求的剧烈下滑,而自建产能应对终端变化的能力明显缺乏。因此在多因素的推动下,传统药企将 非核心的产能转移至 CDMO企业并形成战略合作的意愿越来越强。最近两年随着全球专利密集到期和国内药品带量采购的全面铺开,专利药在过期后的收入大幅下滑, 高毛利水平难以维持,很多巨头药企开始陆续剥离生产、海外研发等非核心资产。不少企业选择中 国企业作为买方或进行深度合作,进一步提高了国内企业在全球的市场份额。比如今年 9 月九洲药 业以 7.9亿对价收购了诺华在苏州的工厂,并签订了 5+5年的长期供应协议,将抗心衰、乳腺癌及白 血病的三款药物的原料药或中间体约定由九洲药业通过苏州诺华供向诺华爱尔兰子公司,且不排除 转移过来更多品种或延长更长供应时间的可能。通过将原有产能出售给中国 CDMO 企业等战略合作 伙伴的方式,来达到压缩运营成本同时保证供应的目的,已成为各大药企不约而同的选项之一;另 外自有工厂产能剥离后势必伴随对 CDMO 外包企业的更多需求,尤其原先主要配合中国市场的药品 工厂,国内 CDMO企业有更大机会承接,从而以此为切入点获取更多品种。而新药研发越来越高的失败风险,也使得大药企更倾向于通过收购中小型 Biotech公司的研发品种或 整体公司来扩增研发管线,而不是将全部研发重心放在体内。而中小型新药公司多数并不具有自建 产能的能力,而是依托于和 CDMO 企业的合作互利共生。综上可见,大型巨头药企和小型新药公司 的外包动力将持续增强。中国 CDMO 企业已具有承接欧美产能基础 , 印度企业优势渐褪欧美地区为主流制药企业及 CDMO企业的发源地,印度凭借语言和成本优势在仿制药及 CMO领域起 势较早。但随着印度 CMO 质量监管爆雷、IP 保护体系的先天缺陷、以及上游原料药端的对外依赖, 近些年来印度 CMO企业有明显萎缩之态,Jubilant、Dr Reddy’s等 CMO企业的全球市场话语权日渐薄 弱。相反,中国凭借海归人才红利及在原料和成本端的优势,快速崛起,已经超过印度,成为除欧 洲和美国以外最大的 CDMO供应地区。在传统质量控制体系及 EHS等体系建设上,欧美 CDMO企业仍然拥有领先十数年至数十年的经验优 势,同时在 FDA审查等方面的地缘便利也要明显优于亚太地区的企业。但随着国内企业的国际化接 轨程度加深,以及国内对于原料药生产企业的监管趋严,我们正在逐步缩小与发达国家间的差距。 产品结构上,目前靠近下游的较高端 CDMO 的大部分仍然掌控在欧美企业手中,而国内企业正在逐 步从早期的中间体渗透到 API 和制剂业务,技术水平提升的同时也将提升国内企业的毛利水平和议 价能力。而在成本端,中国和印度等地则具有毋庸置疑的优势。相较于欧美企业的同类业务,平均可以降低 30-50%左右的成本。这对于在研新药、专利药或大宗的原料药来说都是极为重要的,在中国和印度 逐渐在技术、质量、监管体系等方面逐渐赶上欧美企业后,便驱动药企更多得从欧美地区转向中印 等地。而中国较印度而言,具有更好的上游供应链优势。据估计,目前印度有近七成的药品原料依靠从中 国进口,因此在前端资源把控及相关成本上,中国都有比印度更好的发展原料药的优势。最重要的 是,印度先天的 IP保护体系缺陷,已经使印度 CDMO企业丧失了大量新药客户,并有逐步被中国替 代的趋势。近几年来,印度 CDMO企业在国际市场影响力明显减弱,主流企业的 CMO收入也在明显 萎缩,全球市场份额已经被中国超越。全球及国内医药投资热情持续,新药 CDMO增量利好国内企业趁势而起新药的 CDMO 业务作为创新药研发产业链上的配套服务,上游来自于新药的研发投入,因此药企研 发支出和医药领域的投资额可以作为重要的前瞻指标。目前国内主流 CDMO 大多仍以海外客户业务 为主,大药企研发支出主要决定医药外包的存量市场,而医药领域的投融资通过中小生物医药公司 传导到下游形成增量市场。目前全球和国内的医药领域投融资仍在高速增加,CDMO 行业中期增长 动力无忧。从全球医疗保健融资情况来看,自 2011年以来总融资额和融资案例数量均快速增长,融资额保持在 40%以上增长,五年复合增速达 73.05%,2018 年融资规模 388 亿美元。其中平均融资额复合增长率 39.44%,年融资事件数复合增长率 24.10%。而国内蓬勃向上的创新药发展更是给国内 CDMO 企业带来了天时地利人和的发展机遇。根据万得统 计,自2017年以来国内医疗保健领域 VC/PE投融资规模保持高速增长,2017和2018年增速分别达59% 和 144%,2018年融资规模已超千亿。截至 2019年 11月末,全年融资额也已接近 800亿元,较国内 鼓励创新政策密集出台前的 2015~2016年水平增长至近三倍。此外,早期 CDMO项目来自于临床前研 发阶段及临床阶段,而商业化 CDMO项目来自于上市新药或邻近上市的临床 III期品种放量。从前一 章关于CRO行业的论述中我们可以看到,国内的新药临床申请及上市申请数量上看,后续动力仍足, 国内新药对于 CDMO行业的拉动效应仍可持续。国内 CDMO 企业与多家新药研发企业已签订战略合作协议,充分发掘双方分别在研发及生产端的优 势,强强联合、深度绑定。近几年包括替尼类小分子肿瘤药在内的多个重磅品种销售放量,后续再 鼎、和黄、艾力斯等新药企业的一系列新药品种上市销售,拉动国内创新药企业大发展的同时也将 推动 CDMO企业趁势快速成长。MAH制度给国内 CDMO市场带来巨大增量空间MAH制度(上市许可持有人制度)从 2015年 11月在我国 10个省市试行,今年新修订的《中华人民 共和国药品管理法》9月 26日全国人大常委会表决通过,其中特别增设第三章“药品上市许可持有 人”,这标志着 MAH 制度在历经四年的试点工作后,成为一项正式运行的制度,并于 12月 1日起施 行。这将直接利好 CDMO企业发展国内市场。原料药进入高景气周期,产业链上价值提升我国原料药行业经历了 2010年之前环保红利期的快速成长和之后专利悬崖期的增长放缓后,近两年 由于海外市场的结构转移以及国内供给端的洗牌,已进入新一轮高景气度周期,且由于壁垒提升和 格局优化,我们判断此轮上升期将持续更长时间并形成更为稳定的寡头竞争格局,此前的高波动性 和周期性有望得到根本性改善。同时在一致性评价、关联审评等一系列政策举措的改革背景下,原 料药企业由低成本竞争向高质量技术驱动升级转型,行业价值链重塑,国内原料药企业向发达国家 市场标准接轨的同时也使得头部优质企业得以获得更高盈利能力。环保安全标准提升,行业洗牌向头部企业集中我国原料药企由于早期欠缺研发能力,有优势的主要是一些技术成熟、产品链长的大宗原料药产品, 品种主要集中在维生素类、解热镇痛类、抗生素类以及皮质激素类。其中青霉素工业盐和维生素 C 为我国化学原料药的两大品种,但同时也因为壁垒不高、大量小产能涌入而造成产能过剩。近年来,由于环保政策压力持续,各地原料药厂成为治污重点。受环保政策法规及其带来的成本上 升影响,大量中小原料药厂被关停。环保压力的加大必将倒逼中小型企业退出市场,使原料药供应 格局得到改善,剩余的龙头企业可以拥有更强的市场议价能力,避免价格战的恶性循环,集中度提 升后的原料药企业将享受更大的市场份额、更高的盈利能力、更低的业绩波动及更良好的发展环境。 原料药中间体行业在产业链上得以迈上新的台阶。在此轮价格上升周期前,原料药行业由于供给过剩及低价竞争,多年来处于低迷状态,且技术含量 低、环保不达标的小型生产企业居多。环保压力和成本压力下,已有大量小型企业退出,仅浙江地 区就有过半的中小原料药企关停退出市场。今年 3 月江苏盐城爆炸事件后,包括江苏省在内的诸多 地区开始对下辖园区及生产企业进行全面核查整改,江苏省已中止所有医药中间体及染料中间体的 新增项目审批。浙江、安徽、山东、河北等多个地区也进行了限产停产整改,小型低级产能进一步 退出。根据国家统计局数据,2018年我国化学原药产量由上年同期的 355.44万吨减少至 282.27万吨,降幅 达 20.59%。近十年首次出现如此大的下滑,而且在之前五年总产量均保持正增长,可见 17年以来的 清查整治对于行业带来了巨大影响。在表面产量缩减的同时,背后是更高的壁垒和更高的技术要求。 之前低景气周期导致的产能清退叠加近两年愈加严格的环保和安全核查,供给收紧,绝大部分原料 药品种形成供方市场,价格稳步上涨。目前行业格局明显向存留下来的大企业集中,而余下的寡头 慢慢形成垄断趋势。环保标准提升意味着对于新入者来说,要投入更多资金、技术水平达到更高层 级(废水废渣处理、通过绿色化学或生物技术从源头减少三废生成等),短期内对于小产能和老牌 厂家而言,新建产能难度都极高。短期供给缺口无法得到解决的情况下,景气度可维持。以质定价,行业格局优化利于头部企业长期发展从原料药出厂价格指数(PPI)来看,从 2015年开始,化学原料药 PPI同比下滑,至 2017年 1月开始, 原料药价格进入上升通道,2017到 2018年保持快速增长。今年虽然同比增速较去年有所减小,但由 于两年余来的产业结构调整和产品涨价已经达到较好的利润水平和较高的景气度,因此价格的相对 较好和稳定的供应格局使得国内原料药企盈利明显增厚。剩余企业在环保支出和成本规模优势的自然筛选下,形成较好的竞争格局,同时达成默契不再通过 打价格战恶性竞争市场,而是维护市场平衡享受提价利好,对于政府或者企业而言都是更好选择。 原料药行业也在这两年逐渐发生质变,由原来的小作坊式低成本低售价竞争变为大型企业通过自身 技术和客户资源的良性发展,通过原料一站式供应、更高的质量管控标准和规模优势竞争客户,更 利于大型企业提高份额、快速成长。随着价格上涨,对生产企业的吸引力增大,部分原有产能开始考虑扩产,但建设及达产仍需较长时 间,因此我们判断,在目前国家主导产业升级的情况下,环保高压势必持续,淘汰落后产能已然成 为全行业的共识,原料药市场的高景气度有望持续较长时间。质量升级提升原料药价值国内近几年大力推行的关联审评和DMF制度等改革推动国内原料药企向更高水平技术驱动的方向进 步。实行药品与药用原辅料关联审批后,对原料药企在质量及质控体系等方面的要求更高,原料药 企的价值不再由原先的批准文号决定,而是要切实通过自身在生产、质控等方面的技术水平保证原 料药的质量和稳定供应,甚至需要协助制剂企业完成等效性试验,证明自身实力后才能获得相应订 单。国内企业逐渐在申报、审批、质控、监管等方面与规范市场接轨,优质的龙头企业逐渐将低级 小产能挤压出场,脱离低价竞争,获得更高质量对应的更高议价权。在对原料药企提出更高要求的同时,由于原料药企业需在制剂企业提交新药或一致性评价的申请时 就进行深度绑定,并对原料药的质量共同跟踪管理,因此也使得原料药和制剂企业的粘性变得更强, 原先行业的周期波动性和公司个体业绩极其不稳定的特性有望得到改善,达到业绩和估值的双向提 升。原料药制剂一体化成为发展大势在药品集采愈演愈烈的情况下,制剂企业的利润率被大幅压缩,原先不合理的过高盈利被截断,以 高额销售费用换高利润率的时代已接近尾声。未来仿制药的价值将从销售端逐步转移向上游原料端, 原料药中间体在整体产业链上的价值和话语权正在提升。同时集中采购将使药企形成中标企业当年需求量极大、但年度间中标不确定性也极高的情况。对于 大多药品而言,同一药品原料药中间体的生产量要远高于制剂的生产量。制剂企业自有原料药产能 难以对年度间巨大变化具备充分应对的灵活性。因此不管从未来产业链价值重心还是从实际保证供 货的层面而言,原料药制剂一体化都将是大势所趋。而由于目前国内对于原料药环保安全方面的高 壁垒和对于未来产能利用的灵活性,原料药企向上延伸会是更为可行的发展方向。据 Newport Premium统计,在全球成熟和较成熟的原料药企业中,约有 36%左右是专门从事原料药生 产的,另外近 2/3 的企业都是同时从事原料药+制剂的复合模式。经海外成熟市场多年发展经验检验, 复合模式也是原料药行业的主要发展模式。在集采的推动下,原料药企可以更容易地跨过销售壁垒, 获得制剂上市许可后更快打开市场放量。现时期将是原料药企业实现一体化进行跨越式发展的良好 机遇。国内原料药在质量升级和格局优化的双重驱动力下,已进入长期上升通道,投资逻辑由周期性慢慢 向长期稳步成长性转变。同时部分已有制剂布局或正在扩大布局的原料药龙头企业有望借助集采机 会快速放量,看好国内原料药龙头企业集中度进一步提升,并在全球市场获得更大的份额和话语权。注射剂一致性评价提上日程,行业洗牌在即2019 年 10 月 15 日,国家药监局发布《化学药品注射剂仿制药质量和疗效一致性评价技术要求(征 求意见稿)》和《已上市化学药品注射剂仿制药质量和疗效一致性评价申报资料要求(征求意见稿)》, 对注射剂一致性评价的参比制剂、处方工艺、原辅包、质量研究与控制、稳定性及特殊注射剂/改规 格注射剂等方面都明确了具体要求。这意味着继两年前原国家食药监局发布《已上市化学仿制药(注 射剂)一致性评价技术要求》后,注射剂一致性评价正式提上日程,预计征求意见结束后近期有望 正式启动。此次征求意见稿共有 11个章节,其中要求企业对已上市注射剂的国内外上市背景、安全性和有效性 数据、上市后不良反应监测情况需进行全面了解,充分评价和确认其临床价值。对于参比制剂、工 艺控制、处方和申报等方面的标准都向 FDA审评标准靠拢,尤其是对于国内企业涉及注射剂的原料 药、辅料、包材、灌装等工艺以及改规格、改基团品种都提出了更高要求,实施后将大大提高现有 注射剂质量水平,这是对国内注射剂企业的一次大的考验,也意味着整个行业将迎来类似口服制剂 的大清洗,现有大量小散企业将退出市场,行业集中度将大幅提升。注射剂企业相对散乱,风险较口服更大,一致性评价更为必要目前国内化学注射剂批文共有 3.38万个,品种数量达 1,370余个,涉及生产企业千余家,格局较为分 散。根据米内网数据,2018年中国公立医疗机构化药注射剂终端市场规模已达 6,152亿元,并仍保持 增长态势。虽然近两年,“能口服不注射、能肌注不静注”是世卫组织提倡的医学基本用药原则,国内在政策 引导下,对注射剂的限制也越来越严,因此公立医院注射剂使用比例逐年降低。但由于注射剂药效 发挥迅速、吸收快,且注射剂不经胃肠道,不受消化系统影响,故剂量准确可靠,适用于不宜口服 给药、消化系统障碍或昏迷、抽搐等状态的患者,因此仍是医药市场的主流剂型,在终端市场份额 占比超过 60%,市场规模仍在逐年上升,但增速持续下滑。由于注射剂直接进入人体血液系统,其不良反应发生率大大高于口服制剂。据《国家药品不良反应 监测年度报告》统计,年度发生的不良反应中,注射剂型药品的占比持续处于较高水平,且还在不 断增加。2013年不良反应中注射剂引起的事件占比为 58.7%,而 2017年这一比重已达到 64.7%,至 2018 年才略有下降,但仍达 64.2%。其中国产注射剂占了相当大比重。因此无论从用药安全、或是行业整 顿的层面,注射剂一致性评价都是势在必行。注射剂一致性标准即将正式出台,行业整合在即注射剂包括注射液、注射用无菌粉末和注射用浓溶液等。一般直接注射入血管、组织或器官,吸收 和起效速度较快,尤其是经静脉注射的注射剂直接进入血液循环系统,是临床使用中风险和不良反 应发生率较高的剂型,对注射剂研发和生产的技术要求也相应更为严格。2017 年 2 月国务院新闻发 布会上首次明确提出将启动注射剂再评价,同年 12月 CDE发布《已上市化学仿制药(注射剂)一致 性评价技术要求》征求意见稿》,但在之后近两年时间里始终没有具体细则发布。至 2019年 3月 29 日,CDE 发布《化学仿制药参比制剂目录(第二十一批)》,其中首次出现了注射剂参比制剂,在 总共 327个品种中有 224个为注射剂,占到此批目录的 68.50%,注射剂一致性评价才重回大家视线焦 点。10月 5日新发布的征求意见稿标志着经过近两年时间的酝酿和修改,注射剂一致性工作准备已 近成熟,即将进入正式施行阶段。化学仿制药注射剂一致性评价并没有给出如口服固体制剂的首批 289 个品种的限定范围,因此除了 提到的氯化钠、葡萄糖、葡萄糖氯化钠和注射用水等注射剂原则上不纳入一致性评价范围之外,几 乎所有化学仿制药注射剂均要开展一致性评价。相较于口服制剂覆盖率更高,对于企业的品种将带 来全面的压力。截至 2019年 12月 18日,通过一致性评价或新分类药品注册(视同通过一致性评价)的注射剂品种 共计 9 个,涉及恒瑞医药、扬子江、海南普利等 8 家企业,其中只有海南普利的注射用阿奇霉素是 以一致性补充申请的渠道申请获批,其他品种均为通过新分类或进口转报途径申请获批。这更多是 由于注射剂一致性评价标准未明确,药企希望通过其他途径尽快抢占先机、曲线救国的原因。在注 射剂一致性评价细则出台后,企业的申报热情将会加强。至 12 月 16 日,国家药品监督管理局药品审评中心已受理按注射剂一致性评价补充申请的受理号达 529个,涉及 136个品种,在 10月 5号发布文件后的两个月内受理号增加近 100个,说明企业申报热 情重新燃起;另有 130 个注射剂一致性评价申请的品种在审。按新注册分类提交上市申请的受理号 有 521个,涉及 199个品种;另有 183个品种在审。注射剂由于体内浓度可控性高,控释难度相对于口服固体制剂更为容易,因此一致性评价的技术难 度相对较低,周期更短。一个品种有三家通过一致性评价后便将纳入全国集采范围,复制口服制剂 中选后“以量换价”的模式,加速集中度提升。在 9月 25日第二轮 25地区药品集中带量采购中,有 5家企业的 3个注射剂中标,有望快速挤掉竞争 对手获得更高市场份额。如果化药注射剂仿制药一致性的正式文件在年内公布,随着注射剂一致性 评价的集中申报,未来 1-2年有望有大量品种通过审批,明年的药品集采将包括更多过评品种在内, 注射剂市场整合即将启幕。根据米内网数据,至 12月中旬,在审的一致性评价或新注册分类注射剂品种共有 310余个,其中有 近半的品种目前为独家申报,而其中有约 70 个品种的公立医院终端销售额过亿,有 21 个终端销售 额超过 10亿。对应的未来市场空间极大。目前注射剂一致性评价工作还在起步阶段,由于注射剂一致性需要时间大概率短于口服制剂,因此 需要企业更快的动作与反应速度才能抢占先机。目前从企业申报数量上来看,注射剂一致性申报最 多的前四家企业分别为科伦药业、正大天晴、扬子江和齐鲁制药,申报品种数量分别达到 46/36/36/32 种。另外恒瑞医药、健友股份、齐鲁制药、海南普利等已获得美国注射剂 ANDA 的企业,具有海外 申报经验及技术优势,有希望在国内注射剂一致性评价的角逐中崭露头角。总体上看,注射剂一致性评价的落地将推动行业加速整合,资源快速向头部企业集聚,小企业淘汰 速度或快于口服制剂企业。同时将推动注射剂企业建立健全风险质控体系,使得国产注射剂质量进 一步提升,逐渐和发达市场接轨。布局早、产品线全、具备技术优势的优质龙头企业更有机会胜出, 有 ANDA申报经验的注射剂出口企业也有希望更快转身抢占更大市场份额。高值耗材集采是趋势,目前不具备全国集采的成熟条件医保局主导高耗集采,价格形成机制是关键,分类集采是趋势2019年 7月 31日,国务院办公厅印发《治理高值耗材改革方案》,主要内容包括:医保局主导耗材 招采,将单价和资源消耗占比相对较高的高值耗材作为治理对象,通过统一编码体系和信息平台、 医保动态调整、完善集中采购方法、取消耗材加成、制定医保支付政策等完善高值耗材价格形成机 制,降低虚高价格;在医院端强调规范医疗服务行为,严控高值耗材不合理使用;明确指出“支持 具有自主知识产权的国产高值医用耗材提升核心竞争力”;并对各项工作列出明确的时间表,2019 年 底前完成第一批重点治理耗材清单、取消耗材加成,2020 年 6 月底建立高值耗材基本医保准入制度、 实行高值耗材目录管理以及健全目录动态调整机制,至 2020 年底要制定医疗器械唯一标识系统规则、 统一全国医保高值耗材分类与编码、强化流通管理制度,并于 2020 年底启动建立高值耗材价格监测 和集中采购管理平台。我们认为,该方案是高值耗材集采的纲要性文件,从生产企业、医院、医保的重要参与环节均提出 改革方案,相关工作明确的时间表将切实推动方案的实际落地。医保局(行业买单者)主导耗材招 采, 完善高值耗材价格形成机制是关键问题,因此,不难理解首先推动医用耗材分类与编码,这是 高值耗材实现带量采购和医保支付标准统一奠定基础,利于降低高值耗材虚高价格。同时方案明确 提出支持有自主知识产权的国产高值耗材提升竞争力,市场份额有望向国产头部企业集中,外资产 品很可能面临更大的降价压力,进一步加快国产替代的进程。试点地区探索高值耗材带量采购医疗器械相对药品而言,种类和型号繁多且复杂,有些器械涉及售后服务、手术跟台等流程,医疗 器械相关的集采很难短时间在较大地域范围内全品类的展开。在医用耗材分类与编码工作在不断的 摸索过程中,目前高值耗材相关的带量采购(不包括传统的省级联合耗材阳光采购) 仍以各省试点 为主,目前已有江苏、安徽、山东、陕西(及其联盟省份)。其中,安徽和江苏两省谈判结果已出, 江苏省已经执行两轮集采,山东和陕西(及其联盟省份)仅出台方案,尚未实际进展。安徽和江苏 模式试点的高值耗材集采覆盖品种规模有限,从选择的品类来开,选择相对较为标准化的产品,例 如人工晶体、心脏支架等。江苏模式涉及的高值耗材降价幅度较大,是市场关注的重点,以支架产品的带量采购为例,支架中 选品种平均降幅 51.01%,最高降幅 66.07%;总结江苏模式的核心在于“价格分组+低价入选”,企业 针对不同分组产品直接报价,按中标价格区分拟必选和拟中选,对应竞标企业而言,“品牌(质量 安全有保证)+产品种类和型号齐全(对应不同分组)+价格优势(保证最低价格入选)”是成功中 标的三要素,这导致了国产企业微创和乐普是江苏此轮集采最大的赢家。在价格超过万元的高价支 架组,由于成本优势,国产企业的原价就略低于进口产品,加之国产企业不用顾忌全球的定价体系, 使得国产产品能够以较高的降幅中选;在低价支架组,在同类国产品牌中,由于国产龙头公司产品 享受一定的品牌溢价,降价幅度更有空间。对于中标企业,虽然终端价格有较大的降幅,但更多的 是压缩了中间环节的水分,对于生产厂家而言,出厂价格没有受到影响+市场份额提升+回款周期短+ 省掉销售费用, 其盈利能力不受影响,甚至可能提升,例如乐普的 GuReater 2850的中标价格仍高于 出厂价,终端降价不影响其盈利能力,由于“带量”,其“必选品种”保证了在江苏省放量的确定 性。综上,我们认为,药品领域降价已经取得明显成果,其经验向高值耗材领域推广是必然趋势,高值 耗材带量采购势在必行,但是考虑到器械和药品领域的差异性,且器械本身的复杂性,短时间内不 可能全国大范围全品类实行高值耗材带量采购,很可能先从试点省份推行,,选择相对标准化、临 床使用量较大和较为成熟、多家企业生产的产品,分类别探索集采;逐步统一全国医保高值耗材分 类与编号,做好产品数据标准化工作;对于生产企业而言,有自主研发能力+产品种类和梯度丰富, 有望在集采过程中提升市场份额。血制品行业经历两轮周期波动,进入低库存、稳增长阶段由于涨价和两票制影响,血制品行业已经历完成去库存周期血制品行业自 2015 年以来,由于价格、厂家的主动营销以及政策因素的扰动经历了三次周期波动。 1. 2015H2-2018H1(主动加库存&库存积压):2015年 6月发改委放开生物制品定价,在血制品涨价预 期下,商业为了囤货大量向上游采购,带动了工业企业加大采浆力度。但随着 2017年下半年两票制 的推开,部分小型商业公司退出市场,为了清理库存大量降价甩货竞争医院终端,血制品价格出现 一定幅度的下跌,工业企业的采浆和批签发速度也同比下降,此时供给大于需求。2. 2018H2-2019H1(主动去库存):之前血制品企业对下游渠道的控制力较弱、主动投入的营销费用 也非常少,两票制导致下游渠道减少,为了降低库存,血制品企业及大型商业公司加大销售端投入, 导致销售费用大幅增长,上市公司整体的销售费用率由 2016年的 4.55%提升至 2018年的 15.39%。随 着费用的投入及学术推广的加强,2018年底至 2019年初白蛋白率先完成去库存,2019H1静丙也完成 去库存,行业供需处于紧平衡状态。3. 2019H2-2020(库存紧张):2019Q1 由于新兴事件的影响,导致血制品批签发变慢且厂家采浆到投 浆的静置窗口期延长,加之 2019H1白蛋白和静丙已经完成去库存,厂家开始控制发货速度,血制品 价格尤其白蛋白出厂价有略微上调。因为厂家新增浆站非常有限,动员献浆员到提升采浆和投浆量 需要较长时间,且批签发将长期保持严格的状态、批签发速度较慢,所以整体供给提速受限,行业 处于供给略小于需求的状态。预计 2020年厂家的销售费用率将下降,厂家对商业的政策会有一定调 整,虽然厂家的盈利情况明显改善,但是库存紧张和新增供给受限,龙头企业的收入端增速会高于 行业均值和采浆增速,保持在 10%-15%左右(净利增速由于费用率下降会高于收入端增速)。从血制品行业的周期变化归结起来,影响供需格局的三大驱动因素有价格、销售费用及学术推广、 政策(两票制/批签发/采投浆)。其中价格与供给端为相互影响关系,政策端在不同的时期起关键作 用的环节有所不同。三大因素在不同的周期发挥着不同的主导作用,且影响的持续时间也不同。预 计未来几年受政策影响行业供给端受限为主要矛盾,血制品的价格会保持平稳或略微上涨,而随着 厂家持续的销售费用投入和学术推广,需求端仍然会保持 10%-12%的稳定增长。从不同品种库存周期的变化角度讲,白蛋白由于医院端认知充分、适应症和市场较广,因此大部分 时间渠道库存高于厂家库存,渠道去库存和补库存的时间节点都是所有品种中最领先的,因此从 2018Q3 开始如华兰生物、天坛生物的业绩增速好转就是由于白蛋白加速去库存引起的。白蛋白的终 端销量增速近几年一直保持在 9%以上,经历去库存后,目前厂家和渠道的库存都保持在较低的位置。静丙属于临床认知不够充分且渠道下沉不足的品种,因此近一半时间厂家库存都高于渠道库存,其 去库存和补库存的时间节点都晚于白蛋白。由于该品种依赖于学术推广,因此终端销量增速的波动 性较大,随着 2019年费用投入及学术推广的加强,终端销量增速快速上升。 2019Q3厂家去库存完毕、 渠道开始补库,因此静丙库存多的企业如天坛生物、泰邦生物上半年业绩增速较快,目前厂家的静 丙库存相对紧张。新一轮周期特点为供给端受限、需求端增长平稳,厂家处于低库存状态目前行业的主要矛盾是供给端受限,除了每年新批浆站数量较少和批签发较慢外,从采浆到投浆的 静置窗口期从原来的 3 个月延长至目前的 4-6 个月,行业采浆增速自 2016 年的高峰下降至目前的 6.5%-7.5%左右,预计未来 2-3年内仍将保持这一增速。各品种供给分化明显,人血白蛋白和静注人免疫球蛋白经过一年的去库存,于 2019Q3单季度批签发 量创新高,其中白蛋白国产和进口的批签发比例持续保持在 40%:60%的水平。而破免和狂免由于主 动免疫需求旺盛,供给加速早于白蛋白和静丙;同样凝血因子八由于临床刚需供给持续增长。因此 对于采投浆增速受限的现状下,加大和重视小品种的供给和推广,也是部分龙头企业所选择的供给 优化策略。从需求角度看,除了乙肝人免疫球蛋白外,其他血制品品种终端销售额长期保持着向上的趋势。 2015Q3-2017Q3由于价格上涨,几乎所有品种的销售额都快速抬升,尤其是纤维蛋白原、破伤风人免 疫球蛋白、人血白蛋白和静注人免疫球蛋白价格涨幅相对较大,销售额增速也更快。经过一年的去 库存后,白蛋白和静丙在学术推广的拉动下,销售额从 2018Q4又快速增长。而对于一些小品种,如 狂免、破免、凝血因子八(含重组)、纤维蛋白原由于临床刚需或主动免疫的需要,基本没有受到 两票制的影响出现库存积压,终端销量持续保持旺盛势头。我们预计随着厂家自 2018年开始主动学 术推广后,在费用的持续投入下(虽然销售费用率有所下降),大部分品种终端销量仍将保持持续 的上升趋势,需求端总体增速将保持在 10%-12%左右。从投资配制角度,对于行业终端需求增速在 10%-12%,上市公司龙头收入增速 10%-15%、净利增速 15%-20%的标的,对于部分投资机构缺乏足够的吸引力。经过 2018H1 血制品板块杀估值行情后,随 着业绩恢复增长,板块估值逐渐修复到 2019H1的 36倍,目前板块估值达到 42倍,已经超过了创业 板和生物制品板块的整体估值。我们认为,在目前制药行业受到集采降价政策的影响下,血制品板 块作为政策避风港具备非常高的配置价值(没有降价或集采风险),这也是板块估值高于创业板和 生物制品板块的原因,建议积极配置华兰生物和天坛生物。国产疫苗行业发展趋势向欧美靠拢,市场逐渐进入寡头格局以美国为例,疫苗安全事故是导致行业集中度提升、监管升级的诱因由于疫苗等生物制品生产过程的不可控性,生产工艺的稳定性和安全性是行业最基本也是最重要的 要求,美国疫苗行业历次的负面事件导致监管法规的完善和升级,1902、1944和 1986年出台了三次 重大立法并对行业影响深远。从 20世纪初疫苗生产、销售、品种注册、流通、上市后监测等法规的 逐步出台和机构的设立,奠定了美国疫苗安全管理体系的架构,使得美国疫苗行业为寡头垄断格局 呈现典型的“二八原则”。1901年美国有 8家疫苗生产企业,至 2018年共有 17家企业,117年间共有 31家疫苗企业退出。其中 23家是因为并购而淡出(包含出现事故而被收购的企业),另外 8家是由于行业负面事件的影响导 致其彻底退出。美国疫苗产业共经历了两段“波折”时期,使得疫苗生产企业数量大幅下降,分别是 20世纪初和 20 世纪 70、80年代,第一次主要是行政许可的力量使得企业退出,第二次是由于“无过失责任制”的 判定导致法律诉讼增加,很多企业因无力承担赔偿而退出。1970至 1986年间,由于针对疫苗生产企 业的诉讼数量增加,部分疫苗企业缩减产品品种,造成市场上疫苗种类的急剧减少。我们认为,区别于美国疫苗行业发展历程中法律诉讼的作用,中国疫苗行业集中度的提高将更多依 靠行政力量的推动(主要是审批及招标准入等制度)。1955 年卡特事故(脊髓灰质炎疫苗事故)开 启的“无过失责任”制度(指疫苗不良反应的受害者无需证明该企业是否在相应疫苗生产过程中出 现过失,可直接要求疫苗生产企业赔偿)为 1970-1986年间疫苗行业集中度的提高及疫苗价格的上升 埋下伏笔。1955年至 1970年间上市的疫苗种类较少,生产企业并未受到该制度的太多影响,截至 1987 年总计有超过 2,100万美元的 800起诉讼出现。为支付巨额补偿费用,疫苗企业不得不提高包括 DTP 疫苗在内的产品价格,但仍有不少企业无力承担赔偿费用而选择退出市场。直到 1986年《国家儿童 疫苗伤害法》的通过及1988年国家疫苗伤害补偿计划的建立,疫苗厂商数量减少的趋势才得到缓解, 疫苗价格也有所下降。经过 1990-2010年间的产业整合,全球疫苗市场也出现集中度提高的趋势。2005年三大巨头的全球市 占率约 62%, 2017年三大巨头市占率约 63.4%,此外辉瑞通过收购惠氏成为第四大巨头市占率 16.3%。2019年美国疫苗市场上四家公司(GSK,赛诺菲,默克,辉瑞)生产超过 20种疫苗,CDC建议常规 接种的 21种疫苗中,有 10种是 1家企业生产、9种是由 2家企业生产、只有 2种疫苗是由两家以上 的公司生产的,其中品种拥有量最多的企业是 GSK、其次为默克和赛诺菲。国内疫苗监管模式向美国靠拢,新型疫苗技术和市场都处于起步阶段发展潜力巨大由于 2018年疫苗事件的社会影响,全球首部疫苗相关法律《疫苗管理法》加速出台,并于 12月 1日 正式实施。全法的两大核心关键词为全程管控、风险管理,对于生产企业的规模、质控、技术工艺 提出了更高的要求,监管的趋势和要求完全向美国靠拢。目前我国共有 45家疫苗生产企业,但真正 有批签发记录的疫苗企业为三十家左右,未来几年无论是疫苗生产企业数量或重复注册的疫苗品种 将会有所下降。国家对疫苗生产实行严格准入制度,上市许可持有人应当具备疫苗生产能力,超出 生产能力确实需要委托,需经国家药监部门批准;不断提高疫苗的质量和技术标准,根据疾病防控、 行业发展对疫苗品种开展上市后评价,对产品设计、生产工艺、安全性或有效性明显劣于预防同类 疾病的其他类疫苗,注销该类所有疫苗的注册证并废止相应国家药品标准。因此行业门槛将会越来 越高、落后品种将逐渐被淘汰,强者恒强、良性循环的成长逻辑将在龙头企业身上逐步兑现。美国作为成熟市场,几乎所有儿童疫苗都纳入了计划免疫体系。除甲肝、轮状病毒和流感疫苗外, 其他疫苗的接种率都超过了 90%。对于卡介苗、脊灰、乙肝、百白破、麻疹、风疹等常规疫苗在世 界范围内的接种覆盖率(渗透率)都较高达到了 60%以上。而新型疫苗在东南亚的接种率相对较低, 如 2017 年东南亚国家轮状病毒完成最后一剂接种的儿童仅占 9%,接种 3 剂肺炎结合疫苗的儿童仅 12%,因此新型疫苗在东南亚地区仍存在较大的增长潜力。根据我们疫苗行业深度报告的测算,国内儿童&青少年中 HPV疫苗将成为最大的品种之一,预计 2031 年达到 360亿,其次为肺炎 13价疫苗达到 114亿、DTaP为基础的四联&五联&六联疫苗到 2030年达到 76亿、EV71疫苗达到 49亿、MCV4超过 40亿,其他疫苗市场规模在 30亿左右。成人新型疫苗中带状疱疹将成为最大的品种 2034年达到 181亿、其次为肺炎球菌多糖疫苗 2030年达 到 42亿、HPV疫苗 2031年达到 28亿、四价流感疫苗 2032年达到 24亿。2016-2030 年儿童&青少年新型疫苗市场的复合增速为 21.34%、成人新型疫苗的复合增速为 28.04%。 若将狂犬病疫苗、Hib疫苗、水痘疫苗、二价脑膜炎结合疫苗、三价流感疫苗等对应的 150亿左右市 场计入,则 2016-2030年儿童&青少年疫苗市场的 CAGR为 10.83%;若叠加成人疫苗市场,则 2016-2030 年总体疫苗市场的 CAGR为 12.16%。从疫苗相关技术发展过程看,一代技术的跨越需要 30-40年左右的时间,一代技术从逐渐成熟到疫苗 上市使用或产品/技术的再次升级需要 10-15 年。下一代的疫苗技术主要集中在病毒载体疫苗、核酸 疫苗和反向疫苗学技术。对于现有的多联多价进口疫苗,相关技术到 2020年已历时 40年发展相当成 熟,我国民营企业涉足疫苗行业是在 20世纪 90年代,这些企业在 2005-2006年开始立项多糖结合或 多联疫苗的研发,通过技术引进及十多年的消化吸收和工艺摸索,目前已经达到相对成熟水平,后 续将处于一个成本持续下降的通道。从全球重要疫苗品种的发展趋势看,肺炎球菌疫苗、流感疫苗、百白破为基础的多联疫苗、轮状病 毒疫苗、脑膜炎疫苗和带状疱疹疫苗,国产水平与国际领先水平存在较大差距,仍然具有研发和创 新的空间,无论从载体蛋白的优化、抗原成分的升级、病毒毒株的优选或基因重组疫苗工艺方面都 是下一代技术需要攻坚的环节。……(报告来源:中银国际证券)(获取报告请搜索“未来智库”,登录下载。)

 40004-98986
40004-98986



